
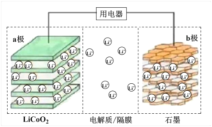
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的结构如图所示,电池反应式为 LixC6 + Li1-xCoO2![]() C6 + LiCoO2(x<1)。下列说法正确的是
C6 + LiCoO2(x<1)。下列说法正确的是
A.放电时,a极为负极
B.充电时,Li1-xCoO2/LiCoO2电极发生Li+脱嵌,放电时发生Li+嵌入
C.放电时,若转移0.02mol电子,石墨电极将减重0.21g
D.放电时,Li+在电解质中由a极向b极迁移
【答案】B
【解析】
根据电池反应式可知,负极反应式为LixC6-xe-=C6+xLi+,正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,即b为负极,a为正极,充电时,阴极、阳极反应式与负极、正极反应式正好相反。
A.根据分析可知,a为原电池的正极,A错误;
B.由电极方程式可知,充电时,Li1-xCoO2/LiCoO2电极发生Li+脱嵌,失去电子;放电时发生Li+嵌入,得到电子,B正确;
C.放电时,石墨电极发生得电子的反应,若转移0.02mol电子,则石墨电极将减重0.02![]() 7=0.14g,C错误;
7=0.14g,C错误;
D.放电时,Li+负极向正极移动,即由b极向a极移动,D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】第3周期某元素的原子,其最外层3p轨道上有一个未成对电子,则关于该元素的描述正确的是( )
A.该元素最高价氧化物的水化物肯定是一种强酸
B.该元素单质可能是一种黄绿色的气体
C.该元素最高价氧化物的水化物肯定是一种强碱,只能与酸反应
D.该元素的原子半径在同周期中肯定是最小的![]() 稀有气体元素除外
稀有气体元素除外![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中
C.用![]() 制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过
制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过![]()
D.由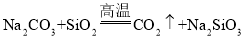 可知,硅酸的酸性强于碳酸
可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家从化肥厂生产的![]() 中检出组成为
中检出组成为![]() 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以![]() 和
和![]() 两种离子形式存在,植物的根系易吸收
两种离子形式存在,植物的根系易吸收![]() ,但它遇到碱时,会生成一种形似白磷的
,但它遇到碱时,会生成一种形似白磷的![]() 分子,
分子,![]() 分子不能被植物吸收。
分子不能被植物吸收。
请回答下列问题:
![]() 和
和![]() 的关系正确的是 ______
的关系正确的是 ______ ![]() 填序号
填序号![]() 。
。
A.同种单质![]() 同位素
同位素![]() 同分异构体
同分异构体![]() 同素异形体
同素异形体
![]() ______
______ ![]() 填“能”或“不能”
填“能”或“不能”![]() 和草木灰混合施用。
和草木灰混合施用。
![]() 已知断裂
已知断裂![]() 吸收167kJ热量,生成1molN
吸收167kJ热量,生成1molN![]() N放出
N放出![]() 的热量,写出
的热量,写出![]() 气体转变为
气体转变为![]() 的热化学方程式: ______ 。
的热化学方程式: ______ 。
![]() 已知白磷、
已知白磷、![]() 、
、![]() 的空间构型均为四面体,
的空间构型均为四面体,![]() 的结构式为
的结构式为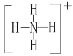 ,白磷
,白磷![]() 的结构式为
的结构式为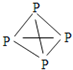 ,请画出
,请画出![]() 的结构式 ______ 。
的结构式 ______ 。
![]() 已知液氨中存在着平衡
已知液氨中存在着平衡![]() ,科学家在液氨中加入氢氧化铯
,科学家在液氨中加入氢氧化铯![]() 和特殊的吸水剂,使液氨中的
和特殊的吸水剂,使液氨中的![]() 生成
生成![]() 分子和另一种单质气体,请写出液氨与氢氧化铯反应的化学方程式: ______ 。
分子和另一种单质气体,请写出液氨与氢氧化铯反应的化学方程式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法中正确的是
的说法中正确的是
A. 所有原子都可能在同一平面上
B. 最多只可能有9个碳原子在同一平面上
C. 有7个碳原子可能在同一直线上
D. 分子中有5个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①0.1 mol/L (NH4)2SO4溶液中各种离子的浓度由大到小顺序为__________。
②用离子方程式表示NaHCO3溶液显碱性的原因:______________。实验室中配制FeCl3溶液时常加入________溶液以抑制其水解。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=____________mol/L,在pH=3的CH3COOH溶液中,水电离出的c(H+)=__________ mol/L。
(3)利用反应Cu + H2O2 + H2SO4 = CuSO4 + 2H2O设计一个原电池,回答下列问题:
①负极材料为____________;正极反应式为__________________________。
②反应过程中SO42-向_______极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐加热来制取,该反应放热:
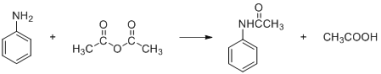
密度(g/mL) | 相对分子质量 | 颜色、状态 | 溶解性 | |
苯胺 | 1.04 | 93 | 无色油状液体 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 无色透明液体 | 遇水缓慢反应生成乙酸 |
乙酰苯胺 | 135 | 无色片状晶体, 熔点 114℃ | 不溶于冷水,可溶于热 水、乙醇、乙醚 |
实验步骤
①取5.00 mL苯胺,倒入100 mL锥形瓶中,加入20 mL水,在旋摇下分批加入6.00 mL 乙酸酐,搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150 mL烧杯中,加入适量水配制成 80 ℃的饱和溶液,再加入过量20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5 min,_______,冷却结晶,抽滤、洗涤、晾干得乙酰苯胺纯品6.2 g。
请回答:
(1)反应温度过高会导致苯胺挥发,下列操作可控制反应温度,防止反应温度升高过快的是______。
A 加20 mL水 B 旋摇下分批加入6.0 mL乙酸酐
C 玻璃棒将块状物研碎 D 充分搅拌
(2)在步骤②中对粗产品进行洗涤需要用到以下操作:
a 加入洗涤剂至浸没固体;b 洗涤剂缓慢通过;c 关小水龙头;d 开大水龙头; e 重复 2~3 次。
请对以上操作做出正确的排序__________。
(3)步骤③加入过量 20%的水的目的是________,横线处的操作步骤是_________。
(4)下列说法不正确的是______。
A 活性炭吸附有色物质,可以提高产率
B 冷却时,室温冷却比冰水浴冷却更易得到大颗粒晶体便于抽滤
C 抽滤用如图装置,为防止倒吸,结束时可先关闭水龙头,后打开活塞a
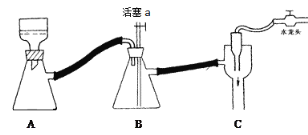
D 产品可放在表面皿上用热水浴烘干,烘干后可通过测量产品熔点判断产品纯度
(5)该实验的产率是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如下图所示,关于该物质的下列说法不正确的是
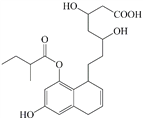
A. 遇FeCl3溶液发生显色反应
B. 能发生取代、消去、加成反应
C. 1 mol该物质最多能与4mol Br2反应
D. 1 mol 该物质最多能与4 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。下表为元素有关信息:
元素 | 信息 |
B | 其单质在常温下为双原子分子,与A可形成分子X,且X的水溶液呈碱性 |
D | 其简单阳离子与X具有相同电子数,且是同周期中简单阳离子中半径最小的 |
E | 元素原子最外层比次外层少2个电子 |
C、F | 两种元素的原子最外层共有13个电子 |
回答下列问题:
(1)B的原子结构示意图为__,且在周期表中的位置为___。
(2)写出BA3气体验满的方法__。
(3)F的单质在氧化还原反应中常做__剂,该单质与E的低价氧化物1:1通入水中,发生反应的离子方程式为__。
(4)C、D形成的化合物的化学式为__,此物质对应的水化物决定了在物质的分类中应属于__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com