
【题目】在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2O) | n(CO2) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min)
B. 实验②中,该条件下反应的平衡常数K =2.0
C. 实验③中,达到平衡时,CO的转化率为60%
D. 实验④中,达到平衡时,b>0.060
【答案】C
【解析】
A.速率之比等于化学计量数之比,则v(H2)=v(CO2)=![]() =
=![]() = 1.0×10-2mol/(Lmin),A项错误;
= 1.0×10-2mol/(Lmin),A项错误;
B.实验②中平衡时CO2为0.080 mol,则:
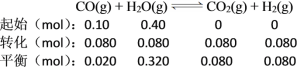
由于反应中气体的化学计量数相等,可以用物质的量代替浓度计算平衡常数,故实验②中,该反应的平衡常数K = ![]() =
=![]() = 1,B项错误;
= 1,B项错误;
C.温度不变,平衡常数不变,则K=1,因平衡时n(CO2) = a mol,则列三段式如下:
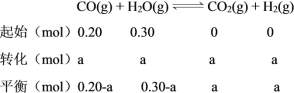
则K=![]() =1,解得a=0.12,实验③中CO的转化率=
=1,解得a=0.12,实验③中CO的转化率=![]() ×100%=60%,C项正确;
×100%=60%,C项正确;
D.该反应为放热反应,则升高温度,平衡常数K减小,所以K(900℃)<K(800℃)<1,平衡时CO2为b mol,则:

则K=![]() <1,解得b < 0.060,D项错误;
<1,解得b < 0.060,D项错误;
答案为C。


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】白杨素对肿瘤细胞有独特的杀伤作用,一种以甲苯、氯苯、丙烯酸为原料合成白杨素的路线如下:
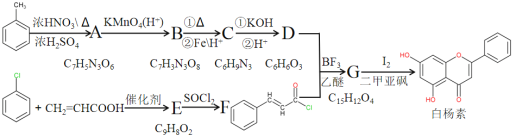
回答下列问题:
(1) A的名称是:__________________。
(2) C和D中不同化学环境的氢原子都为两种,则C和D的结构简式分别为:______、______。
(3) “D+F→G”的方程式为:_____________,物质E经“E→F”过程后再与D反应可大大减少副产物__________的生成。
(4) “G→白杨素”的反应类型为:_____________。试剂I2的选择是整个合成路线的关键。I2不能用更易结合H原子的Cl2替代的原因是:___________________。
(5) 下列关于白杨素的说法正确的是:_________。
A.白杨素的分子式C15H9O4
B.白杨素遇FeCl3溶液发生显色反应
C.与溴水反应,1mo白杨素最多消耗3molBr2
D.与足量H2发生加成反应后,白杨素分子中官能团种类减少1种
(6) E有多种同分异构体,满足分子中含有苯环,且能与4倍物质的量的银氨溶液反应的种类数有_________种,其中不同化学环境的氢原子有4种的结构简式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
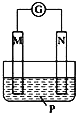
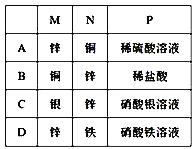
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN﹣、Cl﹣
B.c(H+)=10﹣12 molL﹣1的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.c(Fe2+)=1 molL﹣1的溶液中:K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙变红的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对相关实验的叙述符合事实的是
A.铁与水蒸气在高温下的反应产物为Fe3O4和H2
B.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中缓慢地加入一绿豆粒大的金属钠,可能观察到的现象是如图

C.用洁净的铂丝蘸取待测液,置于酒精灯火焰上灼烧,观察到火焰呈黄色,则表明待测液中一定含有Na+而不含K+
D.用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B. 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物,失去的电子数为0.2 NA
C. 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 金属钠着火时使用泡沫灭火器灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2L 由 NaCl、MgCl2、CaCl2 组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是

A.3.0molB.2.0molC.1.0molD.0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括氟、氯、溴、碘、砹等元素,位于元素周期表中第ⅦA族。
(1)画出下列卤族元素的原子结构示意图:①氟________;②氯________③溴________;④碘_________。
(2)比较卤族元素的原子结构:
①它们在结构上的相同点是____________;
②它们在结构上的不同点是_____________。
(3)卤族元素原子结构的变化规律是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的成分主要为 FeCr2O4 ,另含有少量 Al2O3 和 SiO2 。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:
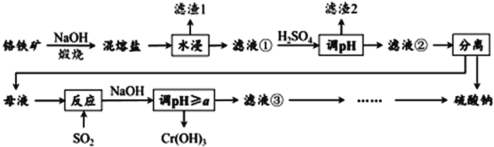
已知:铬铁矿FeCr2O4 中Cr元素在化合价为+3,“ 混熔盐 ” 中含有 Na2CrO4 和 NaFeO2 等成分,其中 NaFeO2 极易水解。试回答下列问题:
(1) “滤渣 1 ”为红褐色沉淀,其化学式为 _________________ ;
(2) 向滤液①中加 H2SO4 “调“ pH ”的目的:一是使 CrO![]() 转化为 Cr2O
转化为 Cr2O![]() ,离子方程式为 __________________ ;二是______________ 。
,离子方程式为 __________________ ;二是______________ 。
(3) “煅烧”铬铁矿时,主要成分反应的化学方程式为 _____________________ 。
(4) 根据下图溶解度(S)~温度(T) 曲线判断,

对滤液②进行的最佳“分离”方法为 ________( 填序号 ) 。
A. 蒸发结晶 B. 蒸发浓缩,趁热过滤 C. 蒸发浓缩,冷却结晶,过滤
(5) “反应”的离子方程式为 ____________________________ 。
(6) 已知 25 ℃时,Cr(OH) 3 的溶度积常数 Ksp [Cr(OH) 3 ]= 1.0 × 10 -32 。则使 Cr 3+恰好完全沉淀,即溶液中c(Cr 3+ )=1.0 × 10 -5 mol/L 时,应调节pH 的最小值a为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com