
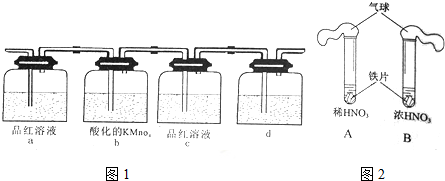
分析 (1)能使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫,碳和浓硫酸在加热条件下反应生成二氧化硫、二氧化碳和水,二氧化硫能使品红溶液褪色,二氧化碳、二氧化硫都能使澄清石灰水变浑浊,注意检验二氧化碳时要先排除二氧化硫的干扰,用酸性高锰酸钾溶液除去二氧化硫,也可用溴水或氯化铁,以此解答该题;
①C、D均能使石灰水变浑浊,说明生成了二氧化碳、二氧化硫,中学化学只有碳和浓硫酸反应可生成这二种气体;
②二氧化硫能使品红褪色,具有漂白性;另外SO2还有还原性,能使溴水褪色;
③CO2能使石灰水变浑浊;
(2)①氮的氧化物属于有毒气体,防止污染环境,要尾气处理;
②稀硝酸与铁反应生成硝酸亚铁、NO和水;
③Fe在常温下遇到浓硝酸会钝化;与硫酸铜溶液不反应,说明铁的表面生成了氧化膜.
解答 解:(1)①能使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫,单质碳可以和浓硫酸反应生成二氧化碳和二氧化硫,方程式为2H2SO4(浓)+C$\frac{\underline{\;加热\;}}{\;}$CO2↑+2H2O+2SO2↑,故答案为:2H2SO4(浓)+C$\frac{\underline{\;加热\;}}{\;}$CO2↑+2H2O+2SO2↑;
②利用SO2的漂白性,用品红溶液检验二氧化硫,用酸性高锰酸钾溶液吸收二氧化硫,也可用溴水或氯化铁溶液,然后用品红溶液检验二氧化硫是否除尽,然后将剩余气体通入澄清石灰水中检验二氧化碳,
故答案为:品红溶液褪色;溴水或氯化铁溶液;
③装置d中所盛溶液是澄清石灰水,用于检验二氧化碳气体,故答案为:澄清石灰水;
(2)①Fe与浓HNO3和稀HNO3反应分别生成二氧化氮和一氧化氮,氮的氧化物属于有毒气体,会污染空气,要尾气处理,所以用气球收集气体目的是防止污染空气;
故答案为:收集产生的气体,防止污染空气;
②稀硝酸与铁反应生成硝酸亚铁、NO和水,其反应的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O;
故答案为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O;
③B中无明显变化,因为Fe在常温下遇到浓硝酸会钝化,不能反应生成二氧化氮气体,所以没有明显现象;将B中的铁片取出并洗净后,放入CuSO4溶液中,与硫酸铜溶液不反应,说明铁的表面生成了氧化膜,因此 证明了浓硝酸将铁片表面氧化形成致密的氧化膜,则假设①不成立;
故答案为:浓硝酸将铁片表面氧化形成致密的氧化膜,阻止反应进一步进行;不成立.
点评 本题考查了元素化合物的性质,为高频考点,侧重于学生的分析能力和实验能力的考查,注意二氧化硫和二氧化碳都能使澄清石灰水变浑浊,检验二氧化碳时要先排除二氧化硫的干扰,注意把握硝酸的性质以及实验设计的原理,难度不大,综合考查学生的分析能力和实验能力.


科目:高中化学 来源: 题型:选择题
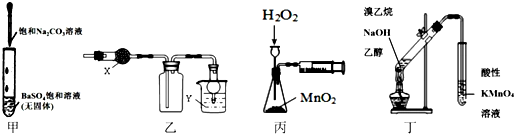
| A. | 甲可用于研究沉淀的转化,可比较出Ksp(BaSO4>Ksp(BaCO3) | |
| B. | 乙中X为无水CaCl2,Y为NaOH溶液时,该装置可用于SO2的收集 | |
| C. | 丙装置可定量测定H2O2的分解速率 | |
| D. | 丁可用于证明实验中生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
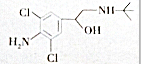
| A. | 该物质含有苯环,属于芳香族化合团 | |
| B. | 该物质只含有-OH,-NH2两种官能团 | |
| C. | 该物质含有-OH,就具有-OH的性质 | |
| D. | 该物质能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、HCO3- | B. | Ag+、Fe3+、Cl- | C. | NH4+、K+、OH- | D. | Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 开始沉淀的PH | 沉淀完全的PH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS03溶液显酸性:HS03-═H++S032- | |
| B. | 苯酚钠溶液中通入少量C02: C6H50+CO2+H20→C6H50H+HCO3- | |
| C. | 强碱性溶液中次氯酸钠溶液与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2Fe042-+3Cl-+H20+4H+ | |
| D. | 向 Ca(Cl0)2 溶液中通入过量 S02:Ca2++2C10-+SO2═CaSO4↓+2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com