
【题目】
以苯和乙炔为原料合成化工原料E的路线如下:
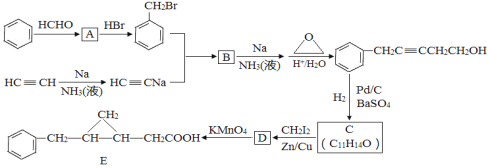
回答下列问题:
(1)A的名称___________________。
(2)生成B的化学方程式为____________________________,反应类型是________。
(3)C的结构简式为____________,C的分子中一定共面的碳原子最多有_____个。
(4)与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有______种,请任写两种同分异构体的结构简式:_____________________________。
(5)参照上述合成路线,设计一条以乙炔和必要试剂合成环丙烷的路线:_____________。
【答案】苯甲醇 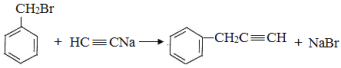 取代反应
取代反应 ![]() 7 4
7 4 ![]()
![]()
【解析】
苯与甲醛发生加成反应生成的A为![]() ,A与HBr发生取代反应生成
,A与HBr发生取代反应生成![]() ,
,![]() 与HC≡CNa发生取代反应生成的B为
与HC≡CNa发生取代反应生成的B为![]() .
.![]() 与氢气发生加成反应生成C,结合C的分子式可知C为
与氢气发生加成反应生成C,结合C的分子式可知C为![]() ,结合E的结构可知C与CH2I2反应生成的D为
,结合E的结构可知C与CH2I2反应生成的D为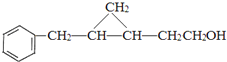 ,D发生氧化反应生成E。
,D发生氧化反应生成E。
(1)A为![]() ,名称为苯甲醇;
,名称为苯甲醇;
(2)生成B的化学方程式为: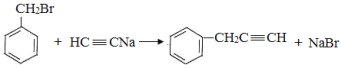 ,属于取代反应;
,属于取代反应;
(3)C的结构简式为![]() ,苯环连接2原子处于同一平面,碳碳双键连接的原子处于同一平面,旋转碳碳单键可以使羟基连接的碳原子处于碳碳双键平面内,由苯环与碳碳双键之间碳原子连接原子、基团形成四面体结构,两个平面不能共面,最多有7个碳原子都可以共平面;
,苯环连接2原子处于同一平面,碳碳双键连接的原子处于同一平面,旋转碳碳单键可以使羟基连接的碳原子处于碳碳双键平面内,由苯环与碳碳双键之间碳原子连接原子、基团形成四面体结构,两个平面不能共面,最多有7个碳原子都可以共平面;
(4)与D( )同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有:
)同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有:![]() 任意2种;
任意2种;
(5)以乙炔合成环丙烷,可以选与氢气加成制备乙烯,再根据题中信息,用乙烯与二碘甲烷合成环丙烷,具体合成路线为:![]() .
.


科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率如下,其中反应速率最大的是( )
A. v(A)=0.15 mol·L-1·min-1 B. v(B)=0.6 mol·L-1·min-1
C. v(C)=0.04 mol·L-1·s-1 D. v(D)=0.01 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
N2(g)+3H2(g)![]() 2NH3(g)△H=-92.60kJ/mol
2NH3(g)△H=-92.60kJ/mol
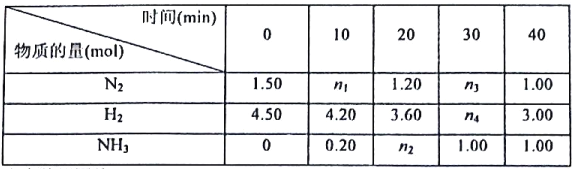
根据表中数据回答:
(1)反应进行到20min时放出的热量为__________kJ。
(2)0-10min内的平均反应速率v(N2)为__________mol/(L·min)
(3)此温度下该逆反应的化学平衡常数K(逆)=__________(保留两位小数).
(4)反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将__________(填“正向移动”或“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下:
Ⅰ: 6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷) ↑+3H2O
Ⅱ: 2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布式__________
(2)砷烷的空间结构为_________;砷烷中心原子杂化方式为________
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3![]() AsH3
AsH3![]() SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
(4)第一电离能数据I(As)____ I(Se)
(5)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图所示。
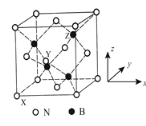
晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是

![]()
A. a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O
D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿 (主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为______、______;滤渣A的主要成分为_______。

(2)Co2O3与浓硫酸反应生成CoSO4,化学方程式为__________________
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12离子方程式为__________________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol/L)时,c(Ca2+)=__________(两位有效数字,Ksp(MgF2)=7.4×10-11,Ksp(CaF2)=1.5×10-10)
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________
Ⅲ.“萃取和反萃取”
(6)“水相C”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol/L的CoCl2溶液5L,忽略损耗,钴的产率=____(产率=产物中元素总量/原料中该元素总量×100%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
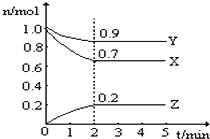
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为___________
(3)其他条件不变,升高温度,逆反应速率将________(填“加快”、“减慢”或“不变”)。
(4)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/S |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ______ 、 ______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 ______ ,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com