
准确称取6g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.求:
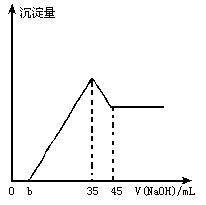
(1)硫酸溶液的物质的量浓度.
(2)若b=2.3,求铝土矿中各成分的质量分数.
|
【答案】(1)1.75mol/L.(2)ω(Fe2O3)=12%;ω(Al2O3)=85%;ω(SiO2)=3%. 【解析】(1)由图像可知当加入35mL NaOH溶液时,滤液中过量的H2SO4被中和,且Fe3+,Al3+全部沉淀,即 (2)从溶解Al(OH)3消耗NaOH溶液10mL,推知用于沉淀Al3+所消耗的NaOH溶液应为30mL,则沉淀Fe3+消耗NaOH溶液为35mL-30mL-2.3mL=2.7mL,再根据反应前后各元素的原子守恒,可分别求出Al2O3,Fe2O3的物质的量: n(Al2O3)=0.5n[Al(OH)3]=0.5×(0.045-0.035)×10=0.05(mol), n(Fe2O3)=n[Fe2(SO4)3]=(1/6)×0.027×10=0.0045(mol), ω(Fe2O3)=(0.0045×160÷6)×100%=12%, ω(Al2O3)=(0.05×102÷6)×100%=85%, ω(SiO2)=1-12%-85%=3%. 【拓展延伸】有关Al(OH)3两性的题目,经常以图表形式出现,这就要求我们运用敏锐的观察力,找出图表中的关键点,尤其是转折点,结合题意,分析出其中的原因,然后根据化学方程式进行正确的解题. |


科目:高中化学 来源: 题型:
 准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示.试回答下列问题:
准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)现有含Fe2O380%的赤铁矿100t,理论上可冶炼含Fe95%的生铁多少吨?
(1)现有含Fe2O380%的赤铁矿100t,理论上可冶炼含Fe95%的生铁多少吨?查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
(1)沉淀A、B的成分分别是 、 ;
(2)步骤②中的试剂a是 ;
(3)试写出步骤③中发生反应的离子方式 ;
(4)在实验室模拟上述实验过程中,需要用到一定浓度的盐酸溶液。在配制250mi。该盐酸溶液时,某同学转移溶液的操作如图所示,图中的主要错误是:
① ;
② 。
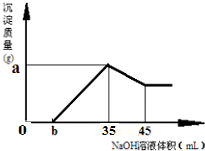
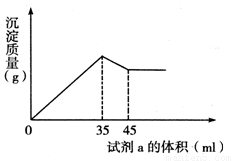
(4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如图所示,则所用盐酸溶液的物质的量浓度为 ,样品中Al2O3的百分含量为 。
查看答案和解析>>
科目:高中化学 来源:2010年山东省诸城一中高三上学期第一次月考(化学) 题型:填空题
(16分)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下: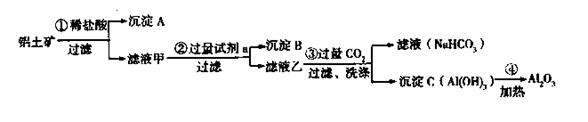
(1)沉淀A、B的成分分别是 、 ;
(2)步骤②中的试剂a是 ;
(3)试写出步骤③中发生反应的离子方式 ;
(4)在实验室模拟上述实验过程中,需要用到一定浓度的盐酸溶液。在配制250mi。该盐酸溶液时,某同学转移溶液的操作如图所示,图中的主要错误是:
① ;
② 。
(4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如图所示,则所用盐酸溶液的物质的量浓度为 ,样品中Al2O3的百分含量为 。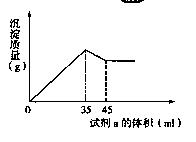
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省梅州市高三上学期期末考试(理综)化学部分 题型:填空题
铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
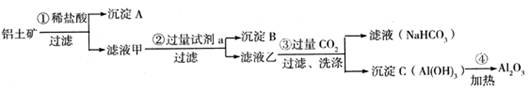
(1)沉淀 A、B的成分分别是 、 ;
(2)步骤②中的试剂a是 ;
(3)试写出步骤③中发生反应的离子方式 ;
(4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如下图所示,则所用盐酸溶液的物质的量浓度为 ,样品中Al2O3的百分含量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com