
A、 |
B、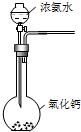 |
C、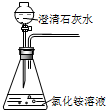 |
D、 |


科目:高中化学 来源: 题型:
| A、燃放鞭炮 | B、配制生理盐水 |
| C、食物腐烂 | D、湿法炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol?L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )
将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol?L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )| A、A点所表示的沉淀是:Al(OH)3、BaSO4 |
| B、B-C段所发生反应的离子方程式是:H++OH-→H2O |
| C、A-B段发生反应的离子方程式:Ba2++SO42-→BaSO4↓ |
| D、拐点E的横坐标为70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:X2->Y+ |
| B、原子的最外层电子数:X>Y>Z>W |
| C、单质沸点:X>Y>Z>W |
| D、X与Y形成的化合物中只2含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其原子最外电子层只1个电子的元素 |
| B、最低负化合价为-3价的元素 |
| C、其原子最外层电子数大于电子层数的元素 |
| D、最高价氧化物对应的水化物是酸的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用加热法除去氯化钠固体中的氯化铵杂质 |
| B、只用铜片不能鉴别浓硝酸和稀硝酸 |
| C、常温下,Al和浓硫酸钝化说明Al和浓硫酸在常温下不反应 |
| D、SO2通入氯化钡溶液无现象,若再通入NH3或NO2气体则都会产生BaSO4的白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:9 | B、1:11 |
| C、9:1 | D、11:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com