
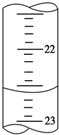
 某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:
某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:分析 ①将酸式滴定管用蒸馏水洗净,用待测稀盐酸润洗后,再注入待测稀盐酸;调整滴定管的尖嘴部分使之充满溶液,并调节液面处于“0”刻度以下的某位置,记下读数;将锥形瓶用蒸馏水洗净后,从酸式滴定管中放出25.00mL待测稀盐酸到锥形瓶中.
②将碱式滴定管用蒸馏水洗净,再用0.10mol/L的NaOH溶液润洗2次后,向其中注入0.10mol/L NaOH溶液,调整滴定管的尖嘴部分使之充满溶液,并调节液面处于“0”刻度以下的某位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定终点时,测得消耗NaOH溶液的体积为V1 mL.
④重复以上过程,测得消耗NaOH溶液的体积为V2 mL.
(1)将锥形瓶用蒸馏水洗净后,不能用待测稀盐酸润洗锥形瓶2次,这样操作会增加待测溶液中的溶质;
(2)读数时目光平视,凹液面最低点与刻度线相切;
(3)步骤③中判断滴定终点的方法是利用酸碱指示剂酚酞的颜色变化判断;
(4)若向锥形瓶中滴入25.00mL NaOH溶液,NaOH和盐酸恰好中和需要盐酸溶液体积25.00ml,若在此基础上多滴1滴NaOH溶液,假定1滴溶液的体积为0.05mL,计算多出的氢氧根离子浓度计算得到溶液PH;
解答 解:(1)实验描述中有一处明显错误,该错误出现在步骤①中,将锥形瓶用蒸馏水洗净后,不能用待测稀盐酸润洗锥形瓶2次,若用待测溶液洗涤会导致待测溶液中溶质增多,测定结果偏高,
故答案为:①;偏高;
(2)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60,
故答案为:22.60;
(3)步骤③中判断滴定终点的依据是:滴入最后一滴NaOH溶液,锥形瓶中溶液由无色变为浅红色,且半分钟内颜色不再改变,
故答案为:滴入最后一滴NaOH溶液,锥形瓶中溶液由无色变为浅红色,且半分钟内颜色不再改变;
(4)若向锥形瓶中滴入25.00mL NaOH溶液,NaOH和盐酸恰好中和需要盐酸溶液体积25.00ml,若在此基础上多滴1滴NaOH溶液,假定1滴溶液的体积为0.05mL,溶液中氢氧根离子浓度=$\frac{0.05ml×0.10mol/L}{50ml}$=0.0001mol/L,氢离子浓度c(H+)=$\frac{1{0}^{-14}}{0.0001}$=10-10mol/L,溶液PH=10,该实验操作下,锥形瓶中会出现滴定终点时溶液颜色的突变现象,
故答案为:10;,会.
点评 本题主要考查了中和滴定操作、误差分析以及常见仪器的读数等知识,题目难度中等,根据课本知识即可完成.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的燃烧热△H=+297.2 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a<b | |
| C. | 1 mol SO2(g)所具有的能量高于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | 16 g固体硫在空气中充分燃烧,可释放148.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内amol A生成,同时生成3amol B | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
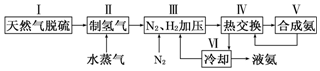
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
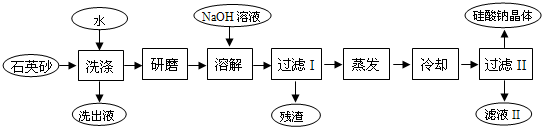
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com