
| A. | NaHCO3溶液 | B. | 石蕊试液 | C. | NaOH溶液 | D. | CuO |
科目:高中化学 来源: 题型:实验题
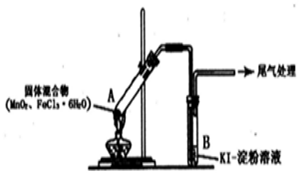
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示加热MnO2与FeCl3•6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把A中的混合物换为FeC13•6H2O,B中溶液换为KSCN溶液,加热. | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向分别装有1gNa2CO3和NaHCO3固体的试管中滴入几滴水,温度高的为Na2CO3 | |
| C. | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,变红,说明样品变质 | |
| D. | 中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,目的是为了混合均匀,充分反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某校化学小组用实验的方法进行探究影响化学反应速率的因素.
某校化学小组用实验的方法进行探究影响化学反应速率的因素.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L-1硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Al. | 反应速率:Al>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 800 mL,93.6 g | B. | 1000 mL,93.6 g | C. | 1 000 mL,117 g | D. | 800mL,117 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量小 | |
| B. | 在镀件上电镀锌,可以用锌做阳极,也可以用惰性材料做阳极 | |
| C. | 二次电池充电过程是化学能转化为电能的过程 | |
| D. | 二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+2H2O | |
| B. | 石灰石与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 酸性氯化亚铁溶液中加入双氧水2Fe2++H2O2═2Fe3++O2↑+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com