


| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
分析 (1)乙酸与乙醇在加热、浓硫酸条件下反应生成乙酸乙酯和水;
(2)长导管不能伸到B试管液面下,防止造成溶液倒吸入加热反应物的试管中;
(3)由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸;
(4)中实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,应保证乙酸、乙醇、氢离子浓度相等;分析使用浓硫酸和稀硫酸的实验,比较哪种条件下生成的乙酸乙酯多,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
解答 解:(1)乙酸与乙醇在加热、浓硫酸条件下反应生成乙酸乙酯和水,其反应的方程式为:CH3COOH+CH3CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
故答案为:CH3COOH+CH3CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(2)长导管不能伸到B试管液面下,防止B试管中溶液倒吸入A试管中,丙装置B试管中导管伸入液面下,容易发生倒吸,
故答案为:丙;
(3)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可.对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇.然后水层中的乙酸钠,根据强酸制弱酸,要用浓硫酸反应得到乙酸,再蒸馏得到乙酸;
故答案为:饱和Na2CO3溶液;分液;蒸馏;
(4)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,应保证乙酸、乙醇、氢离子浓度相等,实验C中 2mL乙醇、1mL乙酸、3mL 2mol•L-1 H2SO4,实验D中 2mL乙醇、1mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,故盐酸体积为3mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为$\frac{3mL×2mol/L×2}{3mL}$=4mol/L,
故答案为:4;
②根据表中数据可知,实验A和C中分别加入了浓硫酸和稀硫酸,所以通过分析实验A、C的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率,
故答案为:AC.
点评 本题考查了乙酸乙酯的制备、混合物分离提纯方法的实验设计,把握乙酸乙酯的反应原理、混合物分离流程、分离方法及发生的反应等为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列变化中,属还原反应的是
A.Cl-→Cl2 B.FeCl2→FeCl3 C.C→CO2 D.KMnO4→MnO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);△H>0,下列叙述正确的是
Z(g)+W(s);△H>0,下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,一定是n(X)∶n(Y)∶n(Z)=1∶1∶1
C.当容器中气体的平均相对分子质量不变时,一定是v(X)∶v(Y)∶v(Z)=1∶1∶1
D.加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
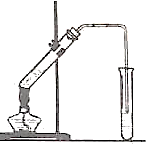 如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
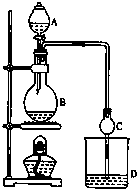 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为可逆反应,不可能进行到底,即乙醇的转化率一定达不到100% | |
| B. | 乙酸挥发,导致其量减少,乙醇过量,不能充分转化为乙酸乙酯 | |
| C. | 产物不稳定,易被氧化为其他物质而影响乙醇的转化率 | |
| D. | 馏出物导入饱和碳酸钠溶液液面上,有较多的乙酸乙酯溶解于水溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com