
分析 (1)①利用n=cV,根据反应前HCl的物质的量减去反应后溶液中HCl的物质的量来计算;
②根据金属的质量之和为1.66g及反应中消耗的HCl来列式计算即可;
(2)根据发生的反应:Fe+CuSO4═FeSO4+Cu,利用差量法来计算溶液中硫酸铜的物质的量,进而计算其物质的量浓度.
解答 解:(1)①反应中消耗HCl的物质的量为:0.2 L×5mol•L-1-0.2 L×4.5mol•L-1=0.1mol,
答:反应中消耗HCl的物质的量为0.1mol;
②设Al、Fe的物质的量分别为x、y
由2Al+6HCl═2AlCl3+3H2↑、Fe+2HCl═FeCl2+H2↑
则Al~3HCl Fe~2HCl
x 3x y 2y
$\left\{\begin{array}{l}{27x+56y=1.66g}\\{3x+2y=0.1mol}\end{array}\right.$,
解得:x=0.02mol、y=0.02mol,
答:该混合物中铝、铁的物质的量分别为0.02mol、0.02mol;
(2)设原溶液中硫酸铜的物质的量为xmol,则:
Fe+CuSO4═FeSO4+Cu△m
1mol 64g-56g=8g
xmol 10.8g-10g=0.8g
1mol:xmol=8g:0.8g
解得x=0.1,n(Fe)=n(CuSO4)=0.1mol,即参加反应的铁的物质的量为0.1mol,所以剩余的铁的质量10g-5.6g=4.4g,
则原溶液中CuSO4的物质的量浓度=$\frac{0.1mol}{0.1L}$=1mol/L,
答:①剩余的铁的质量为4.4g;
②原硫酸铜溶液的物质的量浓度为1mol/L.
点评 本题考查化学反应方程式的计算,注意利用差量法来计算,简化计算过程,难度不大.


科目:高中化学 来源: 题型:选择题
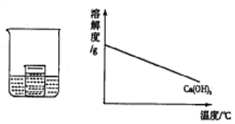 如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )
如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )| 序号 | 试剂X | 试剂Y | 小烧杯中的现象 |
| A | 水 | 硝酸铵 | 产生白色沉淀 |
| B | 水 | 浓硫酸 | 无明显变化 |
| C | 盐酸 | 镁条 | 产生白色沉淀 |
| D | 硫酸 | 氢氧化钠 | 无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
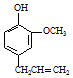 丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图.
丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图. .
.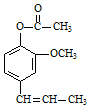 →A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(
→A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(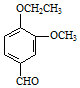 )
)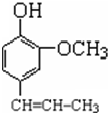 +CH3CH2Cl$\stackrel{一定条件}{→}$
+CH3CH2Cl$\stackrel{一定条件}{→}$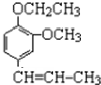 +HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.
+HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
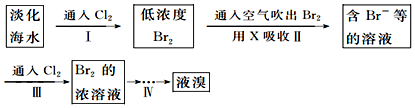
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
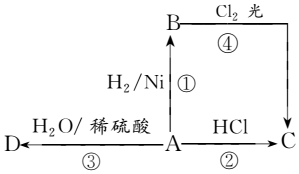 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn片是正极,Cu片是负极 | B. | 电流方向是从Zn经外电路流向Cu | ||
| C. | 电解液的PH保持不变 | D. | Cu片上有气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com