
(13��)��������͵��������dz��õĻ���ԭ�ϣ�Ҳ�����������������Ⱦ���ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��1������β������Ҫ����CO��NO2��SO2��CO2���壬���� �ܵ��¹⻯ѧ�������γɣ�
Ŀǰ���õ�������������װ���а�װһ����������������Ч�Ľ�β���е��к�����ת�����磺CO��g��+NO2��g�� NO��g��+CO2��g�� ��H=��akJ��mol��1��a>0��2CO��g��+2NO2��g�� N2��g��+2CO2��g�� ��H=��bkJ��mol��1��b>0��
�ݴ˻ش����ñ�״����3.36��CO��ԭNO2��N2��CO��ȫ��Ӧ��������������ת�Ƶ��ӵ����ʵ���Ϊ mol���ų�������Ϊ kJ���ú���a��b�Ĵ���ʽ��ʾ����
�����Ͱ��������������Ļ�ѧԭ���Dz��ð�ˮ���������е�SO2������һ�������������������ղ��ﷴӦ���ü������ŵ�����ܻ�������SO2�⣬���ܵõ�һ�ָ��Ϸ��ϣ��ø��Ϸ��Ͽ��ܵĻ�ѧʽΪ ��ֻҪ��дһ�֣���
��3����ҵ����������ʱ����SO2����ΪSO3�ǹؼ�һ����
��ij�¶��£�SO2��g����1/2O2��g��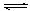 SO3��g������H=" ��98" kJ�� mol��1����ʼʱ��10L���ܱ������м���4.0mol SO2(g)��5.0molO2(g)������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K= ��
SO3��g������H=" ��98" kJ�� mol��1����ʼʱ��10L���ܱ������м���4.0mol SO2(g)��5.0molO2(g)������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K= ��
��һ�������£���һ���������ܱ������г���2molSO2��1molO2���������з�Ӧ��2SO2��g����O2��g��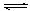 2SO3��g���ﵽƽ���ı���������SO3�����������������
2SO3��g���ﵽƽ���ı���������SO3�����������������
A�������¶Ⱥ�����ѹǿ���䣬����2mol SO3����
B�������¶Ⱥ�����������䣬����2mol N2
C�������¶Ⱥ�����������䣬����0.5mol SO2��0.25mol O2
E�������¶� F���ƶ�����ѹ������
��4��ij������������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ��
��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(13��)ʵ������ȡ��ϩ�������¶ȹ��߶�ʹ�Ҵ���ŨH2SO4��Ӧ���������Ķ������������������ʵ����ȷ�������������������ϩ�Ͷ�������
(1)ʵ������ȡ��ϩ�Ļ�ѧ����ʽ_____________________����Ӧ����Ϊ_______��
(2)��װ�ÿ�ʢ�ŵ��Լ��Ǣ�______;��_____;��; _____��_______��(�������й��Լ����������ո���)
A.����KMnO4 B. Ʒ����Һ C. NaOH��Һ D. ŨH2SO4
(3)��˵����������������ڵ�������__________________________________��
(4)װ�â��п�ʼ��Ӧʱ�����ӷ���ʽ��______________________________��
(5)ʹ��װ�â��Ŀ����______________________________________________��
(6)ȷ֤������ϩ������_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
(13��)��.һ����̼��һ����;�൱�㷺�Ļ�������ԭ�ϡ�
(1)�������з�Ӧ���Խ�����ת��Ϊ���ȴ�99.9%�ĸߴ�����
Ni(s)��4CO(g)Ni(CO)4(g) �÷�Ӧ�Ħ�H �� 0 (ѡ�������������)��
(2)�ڸ�����һ����̼�ɽ���������ԭΪ��������֪��
C(s)��O2(g)��CO2(g) ��H1����393.5 kJ��mol��1
CO2(g)��C(s)��2CO(g) ��H2��+ 172.5 kJ��mol��1
S(s)��O2(g)��SO2(g) ��H3����296.0 kJ��mol��1
��д��CO��SO2���Ȼ�ѧ����ʽ �� ��
(3)��ͼ����ͼ��һ̼����ȼ�ϵ�أ�����COΪȼ�ϣ�һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ���ͼ�Ǵ�ͭ������װ��ͼ������ȼ�ϵ��Ϊ��Դ���д�ͭ�ľ���ʵ�顣�ش��������⣺
��д��A�������ĵ缫��Ӧʽ �� ��
��Ҫ��ȼ�ϵ��Ϊ��Դ���д�ͭ�ľ���ʵ�飬��B��Ӧ���� �� �� (���C����D��)������
�۵�����2.24 L(�����)COʱ����ͭ�缫�����ϼ���ͭ������ �� (������ڡ��������ڡ� ��С�ڡ�)6.4�ˡ�
��.(1)��֪Na2CrO4��Һ�ữʱ�����ķ�ӦΪ��2CrO42����2H��Cr2O72����H2O����1L�ữ��������Һ�и�Ԫ�ص������ʵ���Ϊ0.55 mol��CrO42����10/11ת��ΪCr2O72������֪������ʱ�÷�Ӧ��ƽ�ⳣ��K��1014�������ữ��������Һ��pH�� �� ��
(2)�����йع��ұ�����CrO42���ķ�ˮҪ����ѧ������ʹ��Ũ�Ƚ���5.0��10��7 mol��L��1���²����ŷš���CrO42���ķ�ˮ����ͨ�����������ַ�����
�ٳ���������������Ա�������BaCrO4������Ksp(BaCrO4)��1.2��10��10�ݣ��ټ�������������δ��������Ba2������������Ա��κ�ķ�ˮ��Ba2����Ũ��Ӧ��С�� �� mol��L��1��Ȼ���ٽ��к����������ܴﵽ�����ŷű���
�ڻ�ԭ����CrO42��![]() Cr3��
Cr3��![]() Cr(OH)3���ø÷�������10 m3 CrO42�������ʵ���Ũ��Ϊ1.0��10��3 mol��L��1�ķ�ˮ��������Ҫ�̷�(FeSO4��7H2O����Է�������Ϊ278) �� Kg(������λС��)��
Cr(OH)3���ø÷�������10 m3 CrO42�������ʵ���Ũ��Ϊ1.0��10��3 mol��L��1�ķ�ˮ��������Ҫ�̷�(FeSO4��7H2O����Է�������Ϊ278) �� Kg(������λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
(13��)��������͵��������dz��õĻ���ԭ�ϣ�Ҳ�����������������Ⱦ���ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��1������β������Ҫ����CO��NO2��SO2��CO2���壬���� �ܵ��¹⻯ѧ�������γɣ�
Ŀǰ���õ�������������װ���а�װһ����������������Ч�Ľ�β���е��к�����ת�����磺CO��g��+NO2��g�� NO��g��+CO2��g�� ��H=��akJ��mol��1��a>0��2CO��g��+2NO2��g�� N2��g��+2CO2��g�� ��H=��bkJ��mol��1��b>0��
�ݴ˻ش����ñ�״����3.36��CO��ԭNO2��N2��CO��ȫ��Ӧ��������������ת�Ƶ��ӵ����ʵ���Ϊ mol���ų�������Ϊ kJ���ú���a��b�Ĵ���ʽ��ʾ����
�����Ͱ��������������Ļ�ѧԭ���Dz��ð�ˮ���������е�SO2������һ�������������������ղ��ﷴӦ���ü������ŵ�����ܻ�������SO2�⣬���ܵõ�һ�ָ��Ϸ��ϣ��ø��Ϸ��Ͽ��ܵĻ�ѧʽΪ ��ֻҪ��дһ�֣���
��3����ҵ����������ʱ����SO2����ΪSO3�ǹؼ�һ����
��ij�¶��£�SO2��g����1/2O2��g��![]() SO3��g������H= ��98 kJ�� mol��1����ʼʱ��10L���ܱ������м���4.0mol SO2(g)��5.0molO2(g)������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K= ��
SO3��g������H= ��98 kJ�� mol��1����ʼʱ��10L���ܱ������м���4.0mol SO2(g)��5.0molO2(g)������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K= ��
��һ�������£���һ���������ܱ������г���2molSO2��1molO2���������з�Ӧ��2SO2��g����O2��g��![]() 2SO3��g���ﵽƽ���ı���������SO3 �����������������
2SO3��g���ﵽƽ���ı���������SO3 �����������������
A�������¶Ⱥ�����ѹǿ���䣬����2mol SO3 ����
B�������¶Ⱥ�����������䣬����2mol N2
C�������¶Ⱥ�����������䣬����0.5mol SO2��0.25mol O2
E�������¶� F���ƶ�����ѹ������
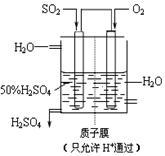
��4��ij������������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��ɳ��һ�п�ǰԤ�����ѧ���� ���ͣ������
(13��)��������͵��������dz��õĻ���ԭ�ϣ�Ҳ�����������������Ⱦ���ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��1������β������Ҫ����CO��NO2��SO2��CO2���壬���� �ܵ��¹⻯ѧ�������γɣ�
Ŀǰ���õ�������������װ���а�װһ����������������Ч�Ľ�β���е��к�����ת�����磺CO��g��+NO2��g�� NO��g��+CO2��g��
��H=��akJ��mol��1��a>0��2CO��g��+2NO2��g�� N2��g��+2CO2��g��
��H=��bkJ��mol��1��b>0��
�ݴ˻ش����ñ�״����3.36��CO��ԭNO2��N2��CO��ȫ��Ӧ��������������ת�Ƶ��ӵ����ʵ���Ϊ mol���ų�������Ϊ kJ���ú���a��b�Ĵ���ʽ��ʾ����
�����Ͱ��������������Ļ�ѧԭ���Dz��ð�ˮ���������е�SO2������һ�������������������ղ��ﷴӦ���ü������ŵ�����ܻ�������SO2�⣬���ܵõ�һ�ָ��Ϸ��ϣ��ø��Ϸ��Ͽ��ܵĻ�ѧʽΪ ��ֻҪ��дһ�֣���
��3����ҵ����������ʱ����SO2����ΪSO3�ǹؼ�һ����
��ij�¶��£�SO2��g����1/2O2��g�� SO3��g������H= ��98 kJ�� mol��1����ʼʱ��10L���ܱ������м���4.0mol SO2(g)��5.0molO2(g)������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=
��
SO3��g������H= ��98 kJ�� mol��1����ʼʱ��10L���ܱ������м���4.0mol SO2(g)��5.0molO2(g)������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=
��
��һ�������£���һ���������ܱ������г���2molSO2��1molO2���������з�Ӧ��2SO2��g����O2��g�� 2SO3��g���ﵽƽ���ı���������SO3 �����������������
2SO3��g���ﵽƽ���ı���������SO3 �����������������
A�������¶Ⱥ�����ѹǿ���䣬����2mol SO3 ����
B�������¶Ⱥ�����������䣬����2mol N2
C�������¶Ⱥ�����������䣬����0.5mol SO2��0.25mol O2
E�������¶� F���ƶ�����ѹ������
��4��ij������������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ��
��
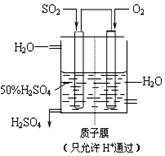
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com