
【题目】经研究发现,新药瑞德西韦对抗冠状病毒有效,其结构如下图,下列关于该有机物说法正确的是( )

A.不能使酸性高锰酸钾溶液褪色
B.与碱溶液反应,与酸溶液不反应
C.分子中所有碳原子一定在同一平面上
D.一定条件下,可以发生取代、加成和氧化反应
科目:高中化学 来源: 题型:
【题目】人体血液中存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值Igx[x表示![]() 或
或![]() 与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是
与pH的关系如图所示。已知碳酸pKa1=6.4,磷酸pKa2=7.2(pKa=-lgKa)。则下列说法正确的是

A.曲线I表示lg![]() 与pH的变化关系
与pH的变化关系
B.a→b的过程中,水的电离程度逐渐减小
C.当pH增大时,![]() 逐渐减小
逐渐减小
D.当c(H2CO3)=c(HCO3-)时,c(HPO42-)=c(H2PO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应后的终止温度
B. HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C. 燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D. S(s)+ ![]() O2(g)
O2(g)![]() SO3(g) ΔH=315 kJ·mol1(燃烧热)
SO3(g) ΔH=315 kJ·mol1(燃烧热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知TNT为烈性炸药,其爆炸时的方程式为:TNT +21O2![]() 28CO2+10H2O+6N2,下列有关该反应的说法正确的是( )
28CO2+10H2O+6N2,下列有关该反应的说法正确的是( )
A. TNT在反应中只做还原剂
B. TNT中的N元素化合价为+5价
C. 方程式中TNT前的化学计量数为2
D. 当1molTNT参加反应时,转移的电子数为30×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示,下列说法中正确的是
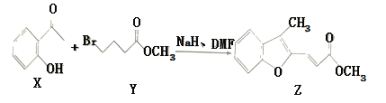
A. Y的分子式为C5H11O2 Br
B. 含苯环和羧基的ⅹ的同分异构体有4种
C. 可以用酸性高锰酸钾溶液鉴别X和Z
D. 1mol Z最多可与6mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐[Mn(H2PO4)2·2H2O]在国防工业中常用作各种武器的润滑层和防护层。以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
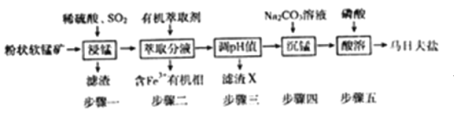
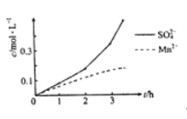
(1)“漫锰”时为了提高浸取率,可采取的措施有_________(任写出一条);在步骤一中,如果SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,产生该现象的原因是_______________;
(2)关于“步骤二”的说法正确的是_________ ;
A.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
B.溶液中加入萃取剂Y,转移至分液漏斗中。塞上玻璃塞,如图用力振摇

C.经几次振据并放气后,手持分液漏斗静置待液体分层
D.分液时,将分液湿斗上的玻璃塞打开或使塞上的四槽对准漏4口上的小孔,打开旋塞,待油水界面与旋塞上口相切,关闭旋塞后再从上口倒出上层液体
(3)已知几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
滤渣X的化学式为_____,步骤三时,pH值应调到的范围是________________;
(4)步骤四时,将Na2CO3溶液逐渐加入锰盐溶液中;若顛倒滴加顺序可能会生成__________已知Ksp(MnCO3)=2.24×10-11,加入饱和Na2CO3溶液使Mn2+恰好沉淀完全后.溶液中c(CO32-)=________;
(5)步骤五产生马日夫盐晶体的化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为![]() a nm 的In 原子有________个。
a nm 的In 原子有________个。
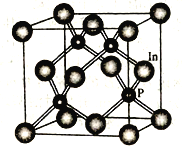
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:xA(气)+yB(气)![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A. x+y<z B. 平衡向右移动
C. B的转化率升高 D. C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L真空的固定容积的密闭容器中,发生反应:N2O4 ![]() 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) /mol | 0.40 | 0.28 | 0.20 | 0.14 | 0.10 | 0.10 |
n(NO2) /mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为__________。
(2)40s时,NO2的的浓度b=_________mol/L,反应最迟到________s到达平衡状态
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
A. 增大N2O4的起始浓度 B. 向混合气体中通入NO2
C. 使用高效催化剂 D. 升高温度
(5)能说明该反应达到平衡状态的标志是_________(填序号)
A. 2 v(N2O4 ) =v(NO2 ) B. 容器内压强保持不变
C. 容器内密度保持不变 D. NO2的体积分数保持不变
(6)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com