
| ||
| ||
| m |
| M |
| ||
| ||
| 8g |
| 16g/mol |
| 0.5mol×4 |
| 2 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的含两种元素的化合物.
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的含两种元素的化合物.| 高温 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
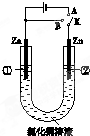 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.查看答案和解析>>
科目:高中化学 来源: 题型:
| O | n- 4 |
| FeO | n- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为2CO+2NO?N2+2CO2△H<0
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为2CO+2NO?N2+2CO2△H<0查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6mol、0.3mol |
| B、1.2mol、0.6mol |
| C、2mol、0.6mol |
| D、2mol、2.4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com