
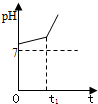
 ��1�������£���pH=6������ˮ�м���2.3g�����ƣ���ַ�Ӧ���ټ�����ˮϡ�͵�1L��������Һ��pH=
��1�������£���pH=6������ˮ�м���2.3g�����ƣ���ַ�Ӧ���ټ�����ˮϡ�͵�1L��������Һ��pH=| 2.3g |
| 23g/mol |
| 0.1mol |
| 1L |
| 10-12 |
| 0.1 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?Ϋ��ģ�⣩��1�������£���һ��2L���ܱ������г���1mol N2��2.6mol H2����Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ����������±���ʾ��
��2013?Ϋ��ģ�⣩��1�������£���һ��2L���ܱ������г���1mol N2��2.6mol H2����Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ����������±���ʾ��| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C��N3H��/��mol/L�� | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ����ѧ�߶���ѧ��3����Ӧ�Կ��Ի�ѧ�Ծ����������� ���ͣ������
���������㣬������ȷ����д�ڿհ״���������ʹ�ü�������
��1�������£���pH �� 6������ˮ�м���2.3 g�����Ƴ�ַ�Ӧ���ټ�����ˮϡ����1L��������Һ��pH ��
��2�������£�pH �� 5��ϡH2SO4��Һϡ��1000������ϡ�ͺ���Һ��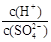 �ı�ֵΪ
�ı�ֵΪ
��3��25�棬�ڵ�����Ģ�pH��0��H2SO4��Һ��0.05 mol/L��Ba(OH)2��Һ��pH��10��K2S��Һ��pH��5��NH4NO3��Һ�з��������ˮ�����ʵ���֮��Ϊ
��4����NH3��H2O��������ǡ���кͳ�c mol/L��NH4Clϡ��Һ������c��c(H��)����ˮ��Kbֵ��ˮ��Kwֵ��ʾ����Һ��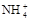 ��ƽ��Ũ�ȣ�c(
��ƽ��Ũ�ȣ�c(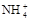 )ƽ��
)ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�˴��и߰���ѧ�߶����ϣ����л�ѧ�Ծ��������棩 ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡ�¿��� ���ͣ�������
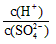 �ı�ֵΪ_______________��
�ı�ֵΪ_______________�� )��c(H+)����ˮ��Kbֵ��ˮ��Kwֵ��ʾ����Һ�е�ƽ��Ũ�ȣ�c(
)��c(H+)����ˮ��Kbֵ��ˮ��Kwֵ��ʾ����Һ�е�ƽ��Ũ�ȣ�c( )ƽ ��___________________��
)ƽ ��___________________�� �鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com