
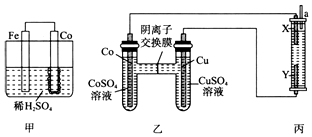
 钴、镍与铁是同族元素,主要化合价均为+2、+3价,它们的单质及化合物的性质有很多相似之处.试回答下列问题:
钴、镍与铁是同族元素,主要化合价均为+2、+3价,它们的单质及化合物的性质有很多相似之处.试回答下列问题:分析 (1)氯化铁溶液中三价铁离子发生水解生成氢氧化铁和氢离子显酸性;
(2)Co3O4能与浓盐酸反应生成黄绿色气体,说明Co3O4做氧化剂被还原,据此书写化学方程式;
(3)设离子的化学式为【Co(SCN)x】(x-2)-,根据离子中钴元素的质量分数约为20%计算x;
(4)甲装置为原电池装置,反应一段时间后Co电极附近产生气泡,则Co为正极,Fe为负极,所以活泼性Fe>Co;丙装置为电解池,其中X极附近溶液变红,说明X极放出氢气为阴极,所以与之相连的Co为负极,则Cu为正极,活泼性Co>Cu;一段时间后,a处收集到1.12 L H2(标准状况)即0.05mol,结合电解氯化钠溶液的方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH以及Cl2+2NaOH=NaCl+NaClO+H2O进行计算比较.
解答 解:(1)氯化铁溶液中三价铁离子发生水解生成氢氧化铁和氢离子显酸性,离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;
(2)Co3O4能与浓盐酸反应生成黄绿色气体,说明Co3O4做氧化剂,将HCl中的氯元素氧化为氯气,Co3O4被还原为CoCl2,故书写化学方程式为:Co3O4+8HCl(浓)=3CoCl2+Cl2↑+4H2O,故答案为:Co3O4+8HCl(浓)=3CoCl2+Cl2↑+4H2O;
(3)设离子的化学式为【Co(SCN)x】(x-2)-,则钴元素的质量分数$\frac{59}{59+58x}$×100%≈20%,解得x=4,所以离子的化学式为【Co(SCN)4】2-,故答案为:【Co(SCN)4】2-;
(4)甲装置为原电池装置,反应一段时间后Co电极附近产生气泡,则Co为正极,Fe为负极,所以活泼性Fe>Co;丙装置为电解池,其中X极附近溶液变红,说明X极放出氢气为阴极,所以与之相连的Co为负极,则Cu为正极,活泼性Co>Cu;所以三种金属的活动性由强到弱的顺序是Fe>Co>Cu;
一段时间后,a处收集到1.12 L H2(标准状况)即0.05mol,又电解氯化钠溶液的方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,所以消耗NaCl0.1mol,生成NaOH刚好与氯气反应,方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,所以最终消耗NaCl0.1mol,生成0.05molNaCl和0.05molNaClO,则反应后的溶液中含有NaCl(1 L×1.5 mol•L-1-0.1mol+0.05mol=1.45mol)和0.05molNaClO,NaClO水解显碱性,所以装置丙中所有离子的浓度由大到小的顺序为c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),故答案为:Fe>Co>Cu;c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+).
点评 本题考查的知识比较综合,涉及到盐类水解,物质性质、化学方程式的书写,原电池和电解池原理等,综合性比较强,难度比较大.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 用饱和Na2CO3溶液除去SO2气体中含有的少量CO2 | |
| B. | 用加热的方法提取NH4Cl固体中混有的少量单质碘 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤的速度 | |
| D. | 用醋和KI淀粉溶液检验食用加碘盐中含有的碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水一种试剂可将苯、四氯化碳、己烯、乙醇、苯酚鉴别开 | |
| B. | 组成为 C4H10O 的醇与乙二酸可生成 10 种二元酯 | |
| C. | 含四个碳原子的有机物,氢原子个数一定为 10 个 | |
| D. | 芥子醇(如图)分子中所有碳原子可能在同一平面内,且与足量浓溴水反应最多消耗1molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2Cl | B. | 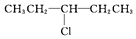 | ||
| C. | 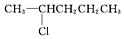 | D. | 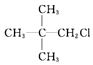 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室可用氯酸钾与密度为1.19g•cm-3,溶质质量分数为36.5%的浓盐酸反应制取氯气.
实验室可用氯酸钾与密度为1.19g•cm-3,溶质质量分数为36.5%的浓盐酸反应制取氯气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测的实验现象 |
| A | 浓盐酸 | 二氧化锰固体 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生白色沉淀 |
| D | 稀硫酸 | 滴有石蕊的亚硫酸钠溶液 | 溶液逐渐变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com