
| A. | 在燃煤时加入石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO4+2CO2 | |
| B. | 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| D. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++PbS═CuS+Pb2+ |
分析 A.反应生成硫酸钙和二氧化碳;
B.发生复分解反应生成醋酸钙、水、二氧化碳;
C.发生沉淀的转化,生成碳酸钙和硫酸钠;
D.发生沉淀的转化,PbS转化为CuS,PbSO4不溶于水.
解答 解:A.在燃煤时加入石灰石,可减少SO2的排放,发生反应为2CaCO3+O2+2SO2═2CaSO4+2CO2,故A正确;
B.用食醋除去暖水瓶中的水垢的离子反应为2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O,故B正确;
C.盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性,发生反应为CaSO4+Na2CO3═CaCO3+Na2SO4,故C正确;
D.然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝的离子反应方程式为Cu2++SO42-+PbS═CuS+PbSO4,故D错误;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应、沉淀转化的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
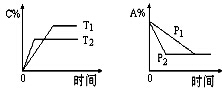 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | ||
| C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 硝酸银溶液中滴入食盐水:Cl-+Ag+═AgCl↓ | |
| D. | 稀盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 叙述Ⅰ | 叙述Ⅱ | |
| A | NaHCO3能与碱反应 | 食品工业用NaHCO3作焙制糕点的膨松剂 |
| B | Al既可和酸反应又可和强碱反应 | Al可制成铝箔包装物品 |
| C | 浓硫酸有吸水性 | 浓硫酸可干燥CO、SO3、H2S |
| D | K2FeO4能与水作用生成Fe(OH)3胶体和O2 | 可K2FeO4用于净化自来水并杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH${\;}_{4}^{+}$):c(NH3•H2O)比值增大 | B. | 所有离子浓度均减小 | ||
| C. | c(OH-):c(NH3•H2O)比值减小 | D. | 电离常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,丙的电子式为
,丙的电子式为 ,E在周期表中的位置为第三周期VA族.
,E在周期表中的位置为第三周期VA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com