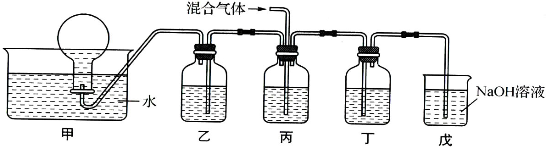
A、B、X、Y、Z、W、Q、R是原子序数依次增大的八种短周期主族元素,A和B、Z和W左右相邻,A和Z、B和W上下相邻;Y在同周期中原子半径最大,R在同周期中原子半径最小;X与Q同主族,能形成QX3化合物.已知Z是金属,其氧化物和氢氧化物均显两性.
(1)写出Z的氧化物与少量Y的最高价氧化物对应水化物的溶液反应的离子方程式______.
(2)单质B、W和WB都是熔点高、硬高大的晶体,B、W、WB、Y的一种氧化物、Q的单质和R的单质,它们的熔点由高到低的顺序(填化学式)______.
(3)A和R能生成共价化合物AR3,该分子是否满足8电子稳定结构______(填“是”或“否”),该分子是______(填“极性”或“非极性”)分子,它和潮湿空气里的水分作用会产生大量白雾,写出其反应的化学方程式______.
(4)由等物质的量浓度Y2QX4和Z2(QX4)3组成的混合液,若在该混合液中逐滴加入氢氧化钡溶液,产生沉淀的物质的量最大时的离子方程式是______.
(5)已知锌锰干电池电极总反应为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+H2O,则该电池正极反应为______.以B、Z为电极可以组成海水电池,这种电池的能量比锌锰干电池高20-50倍,可用作航标灯的电源,写出该原电池负极的电极反______.
【答案】分析:利用题干条件,“已知Z是金属,其氧化物和氢氧化物均显两性”作为解题的突破口,首先判断Z为铝,接着利用位置关系,推出其他元素,结合元素化合物的知识和电化学知识给与解决.
解答:解:(1)已知Z是金属,其氧化物和氢氧化物均显两性,判断Z为铝;Y在同周期中原子半径最大,B和W上下相邻;A、B、X、Y、Z、W、Q、R是原子序数依次增大的八种短周期主族元素,综合以上条件,可判断Y为钠;故答案为Al2O3 +2OH -═2AlO2-+H2O;
(2)根据晶体类型可以判断不同类型的晶体熔点高低,晶体的熔沸点的一般规律为:原子晶体>离子晶体>分子晶体,同种类型的晶体看化学键键能的大小判断,单质B、W和WB都是原子晶体,Y的一种氧化物是离子晶体,Q的单质和R的单质为分子晶体,故答案为:C>SiC>Si>Na2O>S>Cl2;或C>SiC>Si>Na2O2>S>Cl2;
(3)A为B元素,R为Cl,共价化合物BCl3,平面三角形,B元素未达到8电子稳定结构,分子为非极性分子,它和潮湿空气里的水分作用会产生大量白雾,
其反应的化学方程式BCl3+3H2O=H3BO3+3HCl,故答案为:否、;非极性;Cl3+3H2O=H3BO3+3HCl;
(4)硫酸钠、硫酸铝与氢氧化钡反应,当铝离子沉淀完全时,则2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓,此时溶液中的硫酸根并没有完全沉淀,再滴加氢氧化钡,生成硫酸钡,即Ba2++SO42-+2Al(OH)3+2OH--=2[Al(OH)4]-+BaSO4↓,生成1molBaSO4但减少2molAl(OH)3,实为沉淀的物质的量减少,故物质的量最大的离子反应2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓,故答案为:2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓;
(5)正极发生还原反应,该电池也是课本介绍的化学电源,明确给出正负极的电极反应,或者先写简单的负极反应,有总的离子反应减去负极反应式即得
2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O;B是碳,Z是铝,较活泼的做负极,故负极反应为Al-3e-=Al3+,故答案为:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O;Al-3e-=Al3+.
点评:本题综合性较强,以元素周期表考查入手,覆盖元素化合物知识、物质结构问题、电化学问题,设点全面,考查到位,是一好题.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
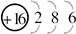
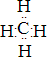
 【化学-物质结构与性质】
【化学-物质结构与性质】