
| A�� | �����к���ʱ�����ý�������������Һ | |
| B�� | �к��Ȳ���һ����ֵ�����С���кͷ�Ӧ�����ĵ���ͼ�Ķ��پ��� | |
| C�� | 50mL0.5mol/LHCl��50mL0.55mol/LNaOH��Һ��Ӧ�ⶨ�к��ȣ�����ʽΪ��H=$\frac{4.18��100}{0.025}$����tKJ/mol ��ע����t-�¶�ƽ���仯���� | |
| D�� | Ϊ�˼�������ȡϡNaOH��Һ��������ͬһ����Ͳ��ȡϡ���� |
���� A���������ȿ죬������ʧ�ࣻ
B���к�����ǿ���ǿ�Ӧ����1molˮʱ�ų��������������������أ�
C���ȸ���Q=m•c•��T���㷴Ӧ�ų���������Ȼ����ݡ�H=-$\frac{Q}{n}$kJ/mol�������Ӧ�ȣ�
D���ò�ͬ����Ͳ��ȡ����ֹ���ǰ��Ӧ���߷�Ӧ������ij�ʼ�¶�ƫ�ߣ�
��� �⣺A���������ȿ죬������ʧ�࣬�����ý�������������Һ����A��ȷ��
B���к�����ǿ���ǿ�Ӧ����1molˮʱ�ų�����������һ����ֵ�����С���кͷ�Ӧ�����ĵ���ͼ�Ķ����أ���B����
C��50mL0.5mol/LHCl��50mL0.55mol/LNaOH��Һ�����кͷ�Ӧ����ˮ�����ʵ���Ϊ0.05L��0.5mol/L=0.025mol����Һ������Ϊ100ml��1g/ml=100g���¶ȱ仯��ֵΪ��t��������0.025molˮ�ų�������ΪQ=m•c•��T=4.18J/��g•�棩��100g����t=0.418����tkJ������ʵ���õ��к��ȡ�H=-$\frac{0.418����tkJ}{0.025mol}$����C����
D��Ϊ�˼�������ȡϡNaOH��Һ����������һ����Ͳ��ȡϡ���ᣬ��ֹ���ǰ��Ӧ���߷�Ӧ����ij�ʼ�¶�ƫ�ߣ���D����
��ѡA��
���� ������Ҫ�������к��ȸ���ⶨԭ������Ӧ�ȵļ��㣬��Ŀ�Ѷ��еȣ�ע�������к��ȵĸ����Լ��ⶨ��Ӧ�ȵ��������⣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 25��ʱKw=1.0��10-14����ϡ���������90�棨������Һ����仯����pH���� | |
| B�� | pH���������ͬ�Ĵ����������Һ�ֱ���0.1mol•L-1����������Һǡ���кͣ����������������Һ���ǰ��һ�����ں��� | |
| C�� | 0.2 mol•L-1CH3COONa��Һ��0.1mol•L-1��������������ü�����Һ�У�c��Na+��+c��H+��=c��CH3COO-��+c��Cl-�� | |
| D�� | ������AgNO3��Һ�еμ�����NaCl��Һ���ٵμ�����KI��Һ������ʼ�а�ɫ�������ɣ�����Ϊ��ɫ��������˵��Ksp��AgI����Ksp��AgCl�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
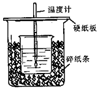 ��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������һ�ֳ��õĻ�ԭ�������û�ѧ����ʽ��ʾ���ڹ�ҵ�ϵ�һ����Ҫ��;��3CO+Fe2O3$\frac{\underline{\;\;��\;\;}}{\;}$2Fe+3CO2��
������һ�ֳ��õĻ�ԭ�������û�ѧ����ʽ��ʾ���ڹ�ҵ�ϵ�һ����Ҫ��;��3CO+Fe2O3$\frac{\underline{\;\;��\;\;}}{\;}$2Fe+3CO2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 672 mL | B�� | 168 mL | C�� | 504 mL | D�� | 224 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 Ϊ̽���ⶨ�к��ȵ�ʵ�飬С������50mL 0.50mol•L-1������50mL 0.55mol•L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȣ��к�����ֵΪ57.3kJ/mol����
Ϊ̽���ⶨ�к��ȵ�ʵ�飬С������50mL 0.50mol•L-1������50mL 0.55mol•L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȣ��к�����ֵΪ57.3kJ/mol�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
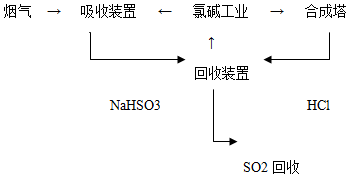
| �����Ʋ� | ʵ�鲽�輰���� |
| �ף�������Fe��OH��3���� �ң����������ϣ����ܷ�����Ӧ�� Fe3++6SO2?Fe��SO2��63+����Ӧb�� | I���Ʊ�Fe��OH��3���岢���� II���ֱ���Fe��OH��3����ú��ɫҺ���м����������ۣ���ǰ�߲���ɫ�����߱�Ϊdz��ɫ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com