
根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,在元素周期表中的位置是____________________。
(2)C元素基态原子的电子排布图是下图中的_______(填序号),另一电子排布图不能作为基态原子的电子排布图是因为它不符合_______(从A B C中选择)。
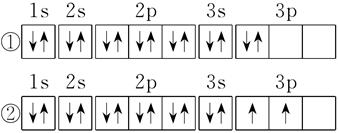
A.能量最低原理 B.泡利原理 C.洪特规则
(3)依据正负化合价代数和等于0,H元素可以放在周期表中的 族
(4)氯化铵的电子式
(10分) (1) 铬 第四周期、第ⅥB族, (2) ② C (3) ⅣA (4)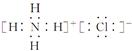
【解析】
试题分析:(1)根据核外电子的排布式可知,1~36号元素原子核外电子排布中未成对电子数最多的元素是铬,位于第四周期第ⅥB族。
(2)在等价轨道(指相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,这就是洪特规则,显然①不符合洪特规则,正确第排布图是②。
(3)依据正负化合价代数和等于0可知,H元素的最高价是+1价、最低价是-1价,所以氢元素可以放在周期表中的ⅣA族。
(4)氯化铵是含有离子键的离子化合物,电子式是 。
。
考点:考查元素在周期表中的位置、核外电子排布以及电子式的书写
点评:该题是基础性试题的考查,也是高考中的常见考点,难度不大,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础性知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。


科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| R | 元素所处的周期数、主族序数、原子序数均相等 |
| T | 最外层电子数是次外层电子数的2倍 |
| X | 元素最高正价+7价 |
| Y | 第三周期金属元素中原子半径最小 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |




查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)根据物质结构与元素周期律及周期表的知识,回答下列问题:
(1)第三周期中,最活泼的非金属元素是(填元素名称) ,其最高价氧化物的水化物的化学式是___ ___。
(2)若用M代表IA族元素,其最高价氧化物的水化物的电子式是_ ____。
(3)某元素A与氟元素能形成离子化合物AF2。其中阴、阳离子的电子层结构相同,则A的元素符号是 。
(4)钾元素与镁元素位于不同周期和不同主族,但可以通过另一种元素作参照,比较出钾与镁的金属性强弱,这种参照元素是 。(填元素名称)
(5)写出表示含有8个质子、10个中子的原子的化学符号: 。
(6)周期表中位于第8纵行的铁元素属于第____族。
(7)周期表中最活泼的非金属元素位于第_____纵行。
(8)所含元素超过18种的周期是第____、___ 周期。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年河北省保北十二县市高一下学期期中联考化学试卷 题型:填空题
(10分)根据物质结构与元素周期律及周期表的知识,回答下列问题:
(1)第三周期中,最活泼的非金属元素是(填元素名称) ,其最高价氧化物的水化物的化学式是___ ___。
(2)若用M代表IA族元素,其最高价氧化物的水化物的电子式是_ ____。
(3)某元素A与氟元素能形成离子化合物AF2。其中阴、阳离子的电子层结构相同,则A的元素符号是 。
(4)钾元素与镁元素位于不同周期和不同主族,但可以通过另一种元素作参照,比较出钾与镁的金属性强弱,这种参照元素是 。(填元素名称)
(5)写出表示含有8个质子、10个中子的原子的化学符号: 。
(6)周期表中位于第8纵行的铁元素属于第____族。
(7)周期表中最活泼的非金属元素位于第_____纵行。
(8)所含元素超过18种的周期是第____、___ 周期。
查看答案和解析>>
科目:高中化学 来源:2013届河南省驻马店市十校联合体高一下学期期中联考化学试卷 题型:填空题
(17分)根据下表部分短周期元素的性质或原子结构,用化学用语回答下列问题。
|
元素编号 |
元素性质或原子结构 |
|
R |
元素所处的周期数、主族序数、原子序数均相等 |
|
T |
最外层电子数是次外层电子数的2倍 |
|
X |
元素最高正价+7价 |
|
Y |
第三周期金属元素中原子半径最小 |
|
Z |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
(1)写出元素T的原子结构示意图 ;元素Z单质的电子式 ;写出X在周期表中的位置 ; 元素T的最高价氧化物的结构式 .
(2)探寻物质的性质差异是学习的重要方法之一。上述T、X、Y、Z四种元素最高价氧化物的水化物的酸性最强的是 (填化学式),其中化学性质明显不同于其他三种化合物的
是 (填化学式),理由是 。
(3)写出R、T、X、三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的化学式
(4)由表中元素形成的常见物质A、B、C、D、E可发生以下反应:

A溶液与B溶液(呈碱性)反应的离子方程式为 。
D中含有化学键的类型是 ,属于 (填“离子”或“共价”)化合物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com