
在以下所列各对化合物中,可看作高分子化合物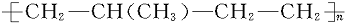 的单体的是 ( )
的单体的是 ( )
A.CH3—CH=CH2和CH2 CH—CH=CH2
CH—CH=CH2
B.CH2=CH2和CH2=CH—CH=CH2
C.CH3—CH2—CH=CH2和CH2=CH—CH3
D.CH2=CH2和CH2=CH—CH3
科目:高中化学 来源: 题型:
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s) ΔH=-235.8 kJ·mol-1。
已知2Ag2O(s)===4Ag(s)+O2(g) ΔH=+62.2 kJ·mol-1,则O3转化为O2的热化学方程式为________________;
②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为________________________
________________________________________________。
(2)用活性炭还原法处理氮氧化物,有关反应为C(s)+2NO(g)N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1 ℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
①10 min~20 min以v(CO2)表示的反应速率为______;
②根据表中数据,计算T1 ℃时该反应的平衡常数为______(保留两位小数);
③下列各项能作为判断该反应达到平衡标志的是______(填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是________;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解 质的水溶液中不存在分子
质的水溶液中不存在分子
C.SO2和乙醇均属共价化合物,在水中都不能电离,均属非电解质
D .不同的弱电解质只要物质的量浓度相同,电离程度也相同
.不同的弱电解质只要物质的量浓度相同,电离程度也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法
中正确的是( )
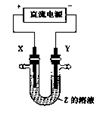
A.氯碱 工业中,X、Y均为石墨,X附近能得到氢氧化钠
工业中,X、Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关煤、石油、天然气等资源的说法正确的是( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可发生加成反应
C.天然气是一种清洁的化石燃料
D.煤就是碳,属于单质
查看答案和解析>>
科目:高中化学 来源: 题型:
有关石油的分馏和煤的干馏两种变化,下列叙述错误的是 ( )
A.加热的温度二者不同
B.获得的产品二者不同
C.前者是物理变化,后者是化学变化
D.前者不需要隔绝空气,后者需隔绝空气
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是 ( )
A.点燃,能燃烧的是矿物油
B.测定沸点,有固定沸点的是矿物油
C.加入水中,浮在水面上的是地沟油
D.加入足量氢氧化钠溶液共热,不分层的是地沟油
查看答案和解析>>
科目:高中化学 来源: 题型:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.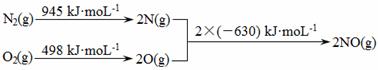
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g) ΔH2= -565 kJ·mol-1
2CO2 (g) ΔH2= -565 kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
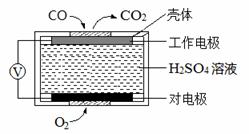 (2)电化学气敏传感器法测定汽车尾气。其中CO传感器的工作原理如右图所示,则工作电极的反应式为
(2)电化学气敏传感器法测定汽车尾气。其中CO传感器的工作原理如右图所示,则工作电极的反应式为
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是 ,用文字和化学用语解释原因
。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化 b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗CO的速率相等
②l0 min内,反应的平均反应速率v (CO2)= 。
③T℃时,该反应的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图1中t0~t1阶段c(B)未画出。

(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=_______。
(2)t4~t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1=________(保留两位小数),K1、K2、K3、K4、K5之间的关系为________________(用“>”“<”或“=”连接)。
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com