
| A. | 5 | B. | 3 | C. | 2 | D. | 4 |
分析 根据恒温恒容条件下,对于反应前后气体分子数改变的反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”)与原平衡相等,则两平衡等效,又因为达平衡后压强不变,所以两个平衡要成完全等效关系,据此计算.
解答 解:根据恒温恒容条件下,对于反应前后气体分子数改变的反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”)与原平衡相等,则两平衡等效,又因为达平衡后压强不变,所以两个平衡要成完全等效关系,即1.4molC换算成A、B,A、B物质的量分别为0.9mol+$\frac{3}{x}$×1.4mol=3mol;0.3mol+$\frac{1}{x}$×1.4mol=1mol,解得x=2,又因数A与B的物质的量之比等于计量数之比,所以当反应前后计量数相等时,也可以保持等效平衡,所以x=4,故选CD.
点评 本题考查的是等效平衡及化学平衡的有关计算,采用极限反应法求出A、B的物质的量,解题的关键是要抓住恒温恒容下压强也不变的等效平衡判断.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
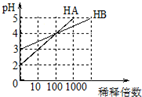
| A. | 向等体积等浓度的HA和HB溶液中滴加等浓度的NaOH溶液,至至溶液呈中性,HB消耗的NaOH多 | |
| B. | 加水稀释HB酸溶液,则c(H+)/c(HB)减小 | |
| C. | 常温下,用pH=a的V1L HA酸与pH=b的V2L NaOH溶液混合,若a+b=14,则反应后溶液呈中性 | |
| D. | 若向等体积等pH的HB和HA酸溶液加入足量锌粉,均反应生成H2,最终HB生成的H2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| B. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| C. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 | |
| D. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=A+n | D. | 所含质子数=A+Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com