
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。

Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
【答案】 原溶液中不含Fe3+,反应后溶液中含有Fe3+ Cu+4H++2NO3-=Cu2++2NO2+2H2O 水 排除乙右侧装置中的残留的NO2 NO、NO2可以与Fe2+水溶液作用产生深棕色,但Fe3+不行 向盛有浓硝酸的试管中,滴入数滴新制FeSO4溶液 Fe2++2H++NO3-=Fe3++NO2+H2O
【解析】(1)向原新制FeSO4溶液中和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红,而由于Fe3+遇KSCN溶液显血红色,故可以说明原溶液中不含Fe3+,反应后溶液中含有Fe3+;
(2)①铜和浓硝酸反应的方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;②打开活塞b、关闭a,乙中需盛装水溶液,使NO2与水反应生成NO,来验证NO与溶液中Fe2+或Fe3+发生的反应:③装置乙有残留的NO2,所以需要反应一段时间后,利用生成的NO来排出装置中的NO2,从而可以获得纯净的NO;④打开活塞a,关闭b时,反应生成的NO2气体通入了FeSO4溶液中后显深棕色,而通入Fe2(SO4)3溶液中无现象;为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同,即NO通入FeSO4溶液后显深棕色,而通入Fe2(SO4)3溶液中无现象,因此实验结论是NO、NO2可以与Fe2+水溶液作用产生深棕色,但Fe3+不行;(3)由于实验I的现象是NO2气体通入了FeSO4溶液中后显深棕色,而通入Fe2(SO4)3溶液中无现象,故可以向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡,浓硝酸被还原为NO2,Fe2+被氧化为Fe3+,此时溶液应该无明显的颜色变化,反应的方程式为 Fe2++2H++NO3-=Fe3++NO2+H2O。


科目:高中化学 来源: 题型:
【题目】按照要求回答下列问题:
(1)基态 Cr 原子的价电子排布式为_______,占据最高能层的电子的电子云轮廓图形状为__。
(2)在BF3分子中,硼原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________,写出BF
的立体构型为________,写出BF![]() 的一种等电子体_______。
的一种等电子体_______。
(3)Fe3+比 Fe2+更稳定的原因是_______________________________。
(4)金刚石晶胞中面心和顶点碳原子替换成硅原子即为金刚砂晶胞,其晶胞如图所示:
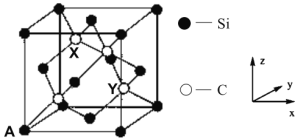
①金刚砂的化学式为_________。
②原子坐标参数表示晶胞内部各原子的相对位置。图中 A 原子坐标(0,0,0),则金刚砂晶胞中碳原子 X 的原子坐标为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g) ![]() CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
A. v生成(CH3OH)=v消耗(CO) B. CO、H2、CH3OH的浓度比为1:2:1
C. 混合气体的密度不再改变 D. 混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.硅晶体和二氧化硅晶体中都含共价键
B.Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大
C.硫酸晶体和硫酸钠晶体均属于离子晶体
D.氯气和氯化氢分子中的氯原子的最外电子层都形成了具有8个电子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识.下图是某化学兴趣小组设计的乙醇催化氧化的实验装置。(提示:通常用新制的Cu(OH)2悬浊液产生砖红色沉淀来检验物质中含有醛基)。

请据图回答以下问题:
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性?答:_____________;
(2)对A中的乙醇采用水浴加热的目的是____________;
(3)实验时,点燃B处的酒精灯后,先____________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是____________,发生的主要反应的化学方程式为____________,当反应进行一段时间后,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个____________反应(填“吸热”或“放热”).
(4)装置C的作用是____________,能在此处观察到的现象是____________;
(5)装置D中的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1molA和nmolB在一个容积可变的密闭容器中发生如下反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是()
2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是()
A. 当n=2时,物质A、B的转化率之比为1: 2
B. 起始时刻和达到平衡后容器中的压强比为(1+n):(l+n-a/2)
C. 当v (A)正=2v (C)逆时,可断定反应达到平衡
D. 容器中混合气体的密度不再随时间改变而改变,反应到达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g) ![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol/L.s B. v(B)=0.3mol/L.s
C. v(c)=0.8mol/L.s D. v(D)=30mol/L.min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下式表示的氧化还原反应设计一个原电池:Zn(s) + Fe2+(aq) == Zn2+(aq) + Fe(s)
(1)装置采用烧杯和盐桥,画出此原电池装置的简图:____________
(2)注明外电路的电子流向____________
(3)写出2个电极上的电极反应_____________、_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可分别通过如下两个反应制取氢气: ( )
a.CH3CH2OH(g)+H2O(g) ![]() 4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g) ![]() 6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
则下列说法正确的是( )
A.乙醇的燃烧热ΔH=-13.8 kJ·mol-1
B.升高反应a的反应温度,乙醇的转化率减小
C.2H2(g)+O2(g)=2H2O(g) ΔH=-229 kJ·mol-1
D.制取等量的氢气,反应b吸收的能量更少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com