
【题目】半富马酸喹硫平可用于精神疾病的治疗,下图所示是其多条合成路线中的一条:
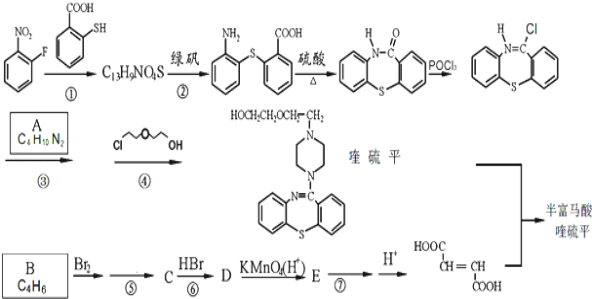
完成下列填空:
(1)反应①的反应类型是___________,反应⑤的试剂及反应条件是___________。
(2)写出结构简式:A___________; B___________。
(3)写出反应⑦的化学方程式_______________________________________________。
(4)写出反应③和④中生成的相同产物的化学式_________。反应⑤和⑦的目的是______________。
(5)化合物![]() 消去HCl后的产物记为F,写出两种F的能发生银镜反应、且只含3种不同化学环境氢原子的同分异构体的结构简式_____________________________。
消去HCl后的产物记为F,写出两种F的能发生银镜反应、且只含3种不同化学环境氢原子的同分异构体的结构简式_____________________________。
【答案】 取代反应 NaOH水溶液、加热 ![]() CH2=CH﹣CH=CH2 HOOC﹣CH2CH(Br)COOH+3NaOH
CH2=CH﹣CH=CH2 HOOC﹣CH2CH(Br)COOH+3NaOH![]() NaOOC﹣CH=CHCOONa+NaBr+3H2O HCl 保护碳碳双键,防止被酸性KMnO4溶液氧化 HCOOCH(CH3)2、
NaOOC﹣CH=CHCOONa+NaBr+3H2O HCl 保护碳碳双键,防止被酸性KMnO4溶液氧化 HCOOCH(CH3)2、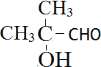
【解析】由反应②产物 可知C13H9NO4S的物质的结构简式为
可知C13H9NO4S的物质的结构简式为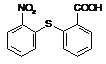 ;根据反应③、④生成产物喹硫平的结构简式可知A的结构简式为
;根据反应③、④生成产物喹硫平的结构简式可知A的结构简式为![]() ;反应③、④分别为
;反应③、④分别为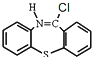 与
与![]() 、ClCH2CH2OCH2CH2OH反应最终生成
、ClCH2CH2OCH2CH2OH反应最终生成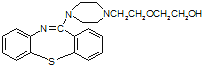 和HCl;由产物
和HCl;由产物![]() 可知分子式为C4H6的烃应为CH2=CH-CH=CH2,与溴发生1,4加成生成CH2Br-CH=CH-CH2Br,CH2Br-CH=CH-CH2Br在NaOH溶液中水解生成HO-CH2-CH=CH-CH2-OH(C),C与HBr加成生成D,则D为HO-CH2-CH2-CHBr-CH2-OH,D氧化后生成E,则E为HOOC-CH2-CHBr-COOH,E发生消去反应生成
可知分子式为C4H6的烃应为CH2=CH-CH=CH2,与溴发生1,4加成生成CH2Br-CH=CH-CH2Br,CH2Br-CH=CH-CH2Br在NaOH溶液中水解生成HO-CH2-CH=CH-CH2-OH(C),C与HBr加成生成D,则D为HO-CH2-CH2-CHBr-CH2-OH,D氧化后生成E,则E为HOOC-CH2-CHBr-COOH,E发生消去反应生成![]() ,所以C为HO-CH2-CH=CH-CH2-OH,D为HO-CH2-CH2-CHBr-CH2-OH,E为HOOC-CH2-CHBr-COOH,(1)根据反应产物
,所以C为HO-CH2-CH=CH-CH2-OH,D为HO-CH2-CH2-CHBr-CH2-OH,E为HOOC-CH2-CHBr-COOH,(1)根据反应产物 可知反应①为取代反应;反应⑤为CH2Br-CH=CH-CH2Br在NaOH溶液中水解生成HO-CH2-CH=CH-CH2-OH,该反应的试剂及反应条件为:NaOH水溶液、加热;(2)根据分析可知A的结构简式为:
可知反应①为取代反应;反应⑤为CH2Br-CH=CH-CH2Br在NaOH溶液中水解生成HO-CH2-CH=CH-CH2-OH,该反应的试剂及反应条件为:NaOH水溶液、加热;(2)根据分析可知A的结构简式为:![]() ,B的结构简式为:CH2=CH-CH=CH2;(3)反应⑦的化学方程式为:HOOC-CH2CH(Br)COOH+3NaOH
,B的结构简式为:CH2=CH-CH=CH2;(3)反应⑦的化学方程式为:HOOC-CH2CH(Br)COOH+3NaOH![]() NaOOC-CH=CHCOONa+NaBr+3H2O;(4)反应③和④中生成的相同产物为HCl;反应⑤⑦的目的是防止C=C被酸性高锰酸钾氧化,起到保护官能团的作用,故答案为:HCl;保护碳碳双键,防止被酸性KMnO4溶液氧化;(5)化合物
NaOOC-CH=CHCOONa+NaBr+3H2O;(4)反应③和④中生成的相同产物为HCl;反应⑤⑦的目的是防止C=C被酸性高锰酸钾氧化,起到保护官能团的作用,故答案为:HCl;保护碳碳双键,防止被酸性KMnO4溶液氧化;(5)化合物![]() 消去HCl后的产物记为F,则F的结构简式为:CH2=CHOCH2CH2OH;能发生银镜反应,分子中含有醛基,可能为甲酸酯或醛类;只含3种不同化学环境氢原子,说明其分子中含有3种等效H原子,满足条件的结构简式有:HCOOCH(CH3)2、
消去HCl后的产物记为F,则F的结构简式为:CH2=CHOCH2CH2OH;能发生银镜反应,分子中含有醛基,可能为甲酸酯或醛类;只含3种不同化学环境氢原子,说明其分子中含有3种等效H原子,满足条件的结构简式有:HCOOCH(CH3)2、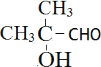 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为了防止金属氧化,宋老师想了很多办法,她发现有些活泼金属在空气中易与氧气反应,表面生成一层致密的氧化膜,可以保护内层金属不被继续氧化的是( )
①铁 ②钠 ③铝 ④镁
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为____________________________。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____________________________________________________。
(2)湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
①浸取液中FeCl3的作用是________________________________。
②操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是___________________________________________________________________。
③将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

ⅰ.溶液3应置于_________ (填“阴极室”或“阳极室”)中。
ⅱ.简述滤液2电解后再生为FeCl3的原理______________________________________。
ⅲ.若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,在酸性条件下CNO-继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
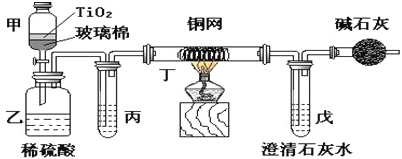
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 molL-1倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)甲中反应的离子方程式为________________________,乙中反应的离子方程式为________________________。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是_____________________,丁在实验中的作用是______________,装有碱石灰的干燥管的作用是______________________________。
(3)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于__________。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能原因之一_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 100mL Na2CO3 与 NaAlO2 的混合溶液中逐滴加入 1mol/L 的盐酸,测得溶液中的 CO32-、HCO3- 、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是
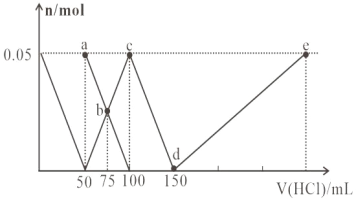
A. 原 混 合 溶 液 中 的 n (CO32-): n (AlO2-)=2:1
B. a 点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C. b 点溶液中离子浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH- )
D. d→e 的过程中水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体的共同点是 ( )
A.分散质颗粒直径都在l~100nm之间
B.用一束平行光照射时,从侧面都可以看到一束光束
C.颜色都呈红褐色
D.都是分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O42H2O,淡黄色)受热分解的部分产物。下列说法正确的 是( )
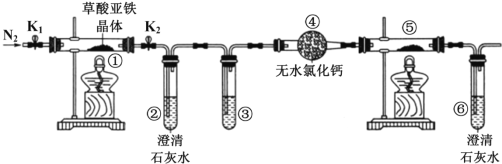
A. 通入N2 的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若将④中的无水 CaC12 换成无水硫酸铜可检验分解生成的水蒸气
C. 若检验有 CO 生成,③和⑤中分别盛放足量NaOH 溶液、CuO
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com