
分析 (1)所含元素化合价升高的反应物为氧化剂;
(2)反应中转移10个电子,双线桥表示电子转移时,同种元素之间由反应物指向反应物;
(3)根据电子转移计算氯气物质的量,再根据V=nVm计算氯气体积.
解答 解:(1)反应中HCl中氯元素由-1价升高为氯气中0价,故HCl为还原剂,故答案为:HCl;
(2)反应中转移10个电子,用双线桥表示电子转移方向与数目为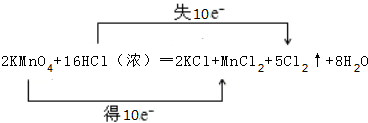 ,
,
故答案为: ;
;
(3)如反应中转移了6mol电子,则产生的气体物质的量为$\frac{6mol}{2}$=3mol,在标准状况下体积为3mol×22.4L/mol=67.2L,
故答案为:67.2L.
点评 本题考查氧化还原反应,涉及基本概念、电子转移表示、氧化还原反应计算等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)=10-7 mol•L-1,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g CO和22.4LCO2中含有的碳原子数一定相等 | |
| B. | ngCl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2L M气体分子的质量为16g,则M气体的摩尔质量是32 | |
| D. | 现有CO、CO2、O3三种气体,它们均含有1 molO,则三种气体的物质的量之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${Fe}_{2}{O}_{3}\stackrel{HCl(aq)}{→}{FeCl}_{3}(aq)\stackrel{△}{→}{Fe(OH)}_{3}(胶体)$ | |
| B. | ${Al}_{2}{O}_{3}\stackrel{NaOH(aq)}{→}{NaAlO}_{2}(aq)\stackrel{HCl(aq)}{→}{AlCl}_{3}$ | |
| C. | ${MgCl}_{2}(aq)\stackrel{石灰乳}{→}Mg{(OH)}_{2}\stackrel{煅烧}{→}MgO$ | |
| D. | $Fe{S}_{2}\stackrel{煅烧}{→}{SO}_{3}\stackrel{{H}_{2}O}{→}{H}_{2}{SO}_{4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O | |
| B. | 2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | Zn+2HCl═ZnCl2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
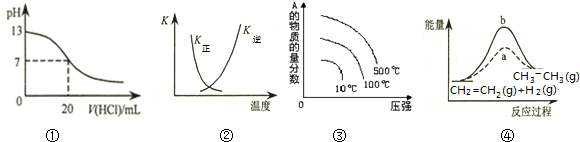
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)═2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 对于可逆反应:A2(g)+3B2(g)?2AB3(g)△H>0,图③表示的是压强、温度、A的物质的量的分数的关系 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g)△H<0,使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com