
| A. | $\frac{(b-a)}{V}$ | B. | $\frac{(2b-a)}{V}$ | C. | $\frac{2(b-a)}{V}$ | D. | $\frac{2(2b-a)}{V}$ |
分析 两等份溶液中一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+),另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-),再利用电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,
一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=bmol,
另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-)=$\frac{1}{2}$amol,
由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),故每份中溶液n(K+)=2b-2×$\frac{1}{2}$amol=(2b-a)mol,
则原混合溶液中钾离子的浓度为$\frac{(2b-a)mol}{\frac{V}{2}}$=$\frac{2(2b-a)}{V}$mol/L,
故选D.
点评 本题考查离子反应的有关计算,为高频考点,根据电荷守恒计算钾离子的物质的量是关键,侧重分析与计算能力的考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
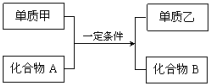 置换反应的通式可表示为:
置换反应的通式可表示为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | B与混合气体的体积比 | 反应后气体密度(已换算为标准状况;g/L) |
| 第一次 | 1.0 | 1.35 |
| 第二次 | 1.2 | 1.25 |
| 第三次 | 2.0 | 1.04 |
| 第四次 | 2.2 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中碘酸钠作还原剂 | |
| B. | 碱性条件下,氯气的氧化性强于高碘酸钠的氧化性 | |
| C. | 反应中氧化产物与还原产物的物质的量之比为2:1 | |
| D. | 反应中生成1 mol Na2H3IO6转移2 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com