
【题目】苯乙烯是重要的基础有机化工原料.工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:C6H5-CH2CH3(g)![]() C6H5-CH=CH2(g) +H2(g)ΔH=a kJmol﹣1
C6H5-CH=CH2(g) +H2(g)ΔH=a kJmol﹣1
(1)向体积为VL的密闭容器中充入n mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:

600℃时,该反应的平衡常数_____________。
(2)乙苯在特定催化剂下发生氧化脱氢:
C6H5-CH2CH3(g)+1/2O2(g)![]() C6H5-CH=CH2(g)+H2O(g) ΔH1
C6H5-CH=CH2(g)+H2O(g) ΔH1
已知 H2的燃烧热ΔH= b kJ/mol,水的汽化热为c J/g,则 ΔH1=____________。
(3)在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。
N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。

(4)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
①由图知该温度下AgCl的溶度积常数为_________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:_______________。

【答案】 n/6V (a+b+0.018c)kJ·mol―1 低温 作图如图所示: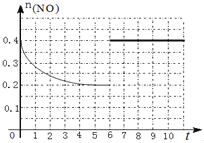 10-12 开始Cl—抑制了AgCl的溶解,所以Ag+浓度变小了,但Cl—浓度增大使AgCl形成[AgCl2]-络合物,所以Ag+浓度又变大了。
10-12 开始Cl—抑制了AgCl的溶解,所以Ag+浓度变小了,但Cl—浓度增大使AgCl形成[AgCl2]-络合物,所以Ag+浓度又变大了。
【解析】(1)①C6H5-CH2CH3(g)C6H5-CH=CH2(g)+H2(g)起始量a mol0 0变化量x molx mol x mol平衡量 (a-x)mol x mol x mol 由图1可知,600℃时乙苯的含量为50%,则: ![]() ×100%=50%,解得x=
×100%=50%,解得x=![]() a,
a,
各物质的平衡浓度:c(C6 H5-CH2 CH3 )=![]() molL-1,c(C6 H5-CH=CH2)=
molL-1,c(C6 H5-CH=CH2)=![]() molL-1,c(H2)=
molL-1,c(H2)=![]() molL-1,则K=
molL-1,则K=![]() ;
;
(2)H2的燃烧热(△H)分别为bkJ.molL-1,可得热化学方程式:①H2(g)+![]() O2(g)=H2O(l)△H=bkJ/mol,水的汽化热为c焦耳/克,则为0.018ckJ/mol,可得:②H2O(l)=H2O(g)△H=0.018ckJ/mol已知③:C6H5-CH2CH3(g)C6H5-CH=CH2(g)+H2(g)△H1=akJmol-1根据盖斯定律,③+①+②可得:C6H5-CH2CH3(g)+
O2(g)=H2O(l)△H=bkJ/mol,水的汽化热为c焦耳/克,则为0.018ckJ/mol,可得:②H2O(l)=H2O(g)△H=0.018ckJ/mol已知③:C6H5-CH2CH3(g)C6H5-CH=CH2(g)+H2(g)△H1=akJmol-1根据盖斯定律,③+①+②可得:C6H5-CH2CH3(g)+![]() O2(g)C6H5-CH=CH2(g)+H2O(g),故△H=akJmol-1+bkJ/mol+0.18ckJmol-1=(a+b+0.018c)kJmol-1;
O2(g)C6H5-CH=CH2(g)+H2O(g),故△H=akJmol-1+bkJ/mol+0.18ckJmol-1=(a+b+0.018c)kJmol-1;
(3)2NO(g)+2CO(g)N2(g)+2CO2(g)△H<0,反应前后气体体积减小△S<0,低温下满足△H-T△S<0,即在低温时反应自发进行;
已知反应为2NO(g)+2CO(g)
则K=![]() =5;第6分钟继续加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,则c(NO)=
=5;第6分钟继续加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,则c(NO)=![]() =0.2mol/L,c(CO)=
=0.2mol/L,c(CO)=![]() =0.2mol/L,c(N2)=
=0.2mol/L,c(N2)=![]() =0.2mol/L,c(CO2)=
=0.2mol/L,c(CO2)=![]() =0.2mol/L,Qc=
=0.2mol/L,Qc=![]() =5=K,说明是平衡状态,所以第6分钟继续加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,仍是平衡状态,但是NO的物质的量变为原来的2倍,作图为
=5=K,说明是平衡状态,所以第6分钟继续加入0.2molNO、0.2molCO、0.2molCO2和0.3molN2,仍是平衡状态,但是NO的物质的量变为原来的2倍,作图为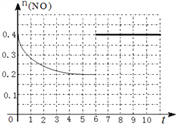 ;
;
(4)当c(Ag+)=10-5mol/L时,c(Cl-)=10-7mol/L,所以AgCl的溶度积常数Ksp=c(Ag+)c(Cl-)=10-5mol/L10-7mol/L=10-12(mol/L)2;(2)根据沉淀溶解平衡:AgCl(s)=Cl-(aq)+Ag+(aq),将氯化银放在氯化钠中,Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-。


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1NaOH溶液分别滴定20.00mL0.100mol·L-1的盐酸和醋酸,滴定曲线如图。不考虑反应的热效应,下列说法正确的是

A. 曲线Ⅰ表示的是滴定盐酸的曲线
B. 滴定醋酸过程中,溶液中 增大
增大
C. V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、H2、CH3、OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) △H1
H2O(g)+CO(g)==H2(g) + CO2(g) △H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) △H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g) ![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充人a mol CO与6 molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②X=___________(用含a、b的式子表示),p1_____p2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为p1、温度为了T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(3)甲醇燃料电池是一种具有高能量转化率的绿色电池,则用磷酸溶液作电解质时,负极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟,应理解为
A、单质 B、分子 C、元素 D、氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能。用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图。下列有关说法正确的是

A. 该电池的总反应为C+O2=CO2
B. 煤直接燃烧发电比直接煤燃料电池发电的能量利用率高
C. 进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响
D. 电子由电极b沿导线流向电极a,入口A加入的物质为煤粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下1mol 苯在空气中完全燃烧,生成液态水,放出热量Q,该反应的热化学方程式是( )
A. C6H6+15/2O2→6CO2+3H2O+Q
B. C6H6(l)+15/2O2(g)→6CO2(g)+3H2O(l)-Q
C. C6H6(g)+15/2O2(g)→6CO2(g)+3H2O(g)+Q
D. 2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+2Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是( )
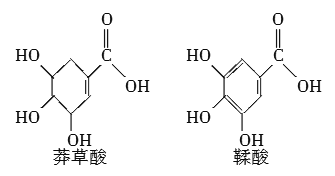
A.两种酸都能与溴水发生加成反应
B.两种酸与三氯化铁溶液都能发生显色反应
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量的金属钠反应产生氢气的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等药效的健康食品。苹果酸(2羟基丁二酸)是这种饮料的主要成分,苹果酸的结构简式如下图所示。下列说法不正确的是( )
![]()
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下)
D. 1 mol苹果酸与过量的Na2CO3溶液反应可生成1mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的碱性溶液中,能大量共存的离子组是
A、 Na+、K+、CO32-、NO3- B、Cu2+、Al3+、SO42-、NO3-
C、 K+、Fe2+、NH4+、NO3- D、NH4+、Na+、NO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com