
| 温度/℃ | 400 | 500 |
| 平衡常数 | 9.94 | 9 |
| 消耗量 |
| 起始量 |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 1.2mol/L |
| 3mol/L |
| 1.2×1.2 |
| 0.8×1.8 |
| x2 |
| (2-x)(6-x) |
| 1.5mol/L |
| 6mol/L |
| c2 |
| (a-c)(b-c) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B、用KIO3 氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
| C、氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ |
| D、0.01 mol?L-1NH4Al(SO4)2溶液与0.02 mol?L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向1mL 1% NaOH溶液加入2mL 2%的CuSO4溶液,振荡后滴加0.5mL葡萄糖溶液,加热 | 未出现红色沉淀 | 葡萄糖中不含有醛基 |
| B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| C | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、NO3-、SiO32-、Na+ |
| B、Na+、Ba2+、HCO3-、AlO2- |
| C、NO3-、Mg2+、K+、Cl- |
| D、NO3-、K+、AlO2-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
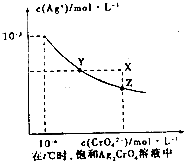 ①已知t℃时AgCl的Kap为2×10-10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
①已知t℃时AgCl的Kap为2×10-10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A、在t℃时,反应Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 |
| B、在t℃时,Ag2CrO4的Kap为1×10-9 |
| C、在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| D、在t℃时,以0.01molL-1AgNO3溶液滴定20mL O.01molL-1KC1和0.01molL-1的K2CrO4的混和溶液,CrO42-先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO+H2O═Ca(OH)2 | ||||
| B、2Na2O2+2H2O═4NaOH+O2↑ | ||||
| C、2Na+2H2O═2NaOH+H2↑ | ||||
D、C+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低 |
| B、由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高 |
| C、合成氨工业的反应温度控制在400~500℃左右,是因为该条件下氨的产率最高 |
| D、合成氨工业采用10 MPa~30MPa,是因该条件下催化剂的活性最好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com