
| A. | c(X2)=0.15 mol•L-1 | B. | c(Y2)=0.7 mol•L-1 | ||
| C. | c(Y2)=0.3 mol•L-1 | D. | c(Q2)=0.6 mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,
X2(g)+4Y2(g)?2Z2(g)+3Q2(g)
起始量 0.1 0.4 0.4 0.3
转化量 0 0 0.6 0.6
转化量 0.2 0.8 0.2 0
据此判断分析.
解答 解:X2(g)+4Y2(g)?2Z2(g)+3Q2(g)
起始量 0.1 0.4 0.4 0.3
转化量 0 0 0.6 0.6
转化量 0.2 0.8 0.2 0
A、X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应X2浓度增大,说明反应逆向进行建立平衡,所以0.1<c(X2)浓度<0.2,故A可能;
B、X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应Y2浓度增大,说明反应逆向进行建立平衡,得到0.4<c(Y2)浓度<0.8,故B可能;
C、X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应Z2浓度增大,说明反应正向进行建立平衡,得到0.2<c(Z2)浓度<0.4,故C可能;
D、X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应Q2浓度增大,说明反应正向进行建立平衡,得到0<c(Q2)浓度<0.6,故D不可能;
故选D.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


科目:高中化学 来源: 题型:解答题

| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸和NaOH溶液混合 | B. | 氯化氢溶于水 | ||
| C. | 溴化氢气体与氨气相遇反应 | D. | 锌和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
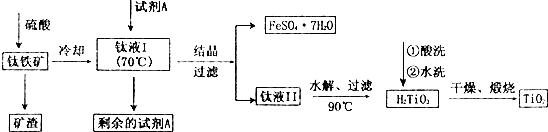
| A. | 过滤 | B. | 蒸发浓缩冷却结晶过滤 | ||
| C. | 水洗 | D. | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气是一种宝贵的资源 | |
| B. | 空气中氮气的质量分数为78% | |
| C. | 氧气易溶于水,供给水生生物呼吸 | |
| D. | 汽车尾气随意排放,与雾霾形成无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com