以NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移4NA个电子
B.100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA
C.常温常压下,6gO2和26gO3混合气体中的原子总数为2NA
D.标准状况下,2.24LCCl4所含的原子数为0.5NA
【答案】
分析:A、根据n=
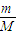
计算氧气的物质的量,氧元素化合价由-1价升高为0价,再根据N=nN
A计算转移电子数;
B、溶液由溶质与溶剂组成,所含微粒指代不明确,无法计算;
C、6gO
2和26gO
3混合气体都是由元素组成,32g质量为氧元素质量,根据n=
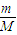
计算氧原子的物质的量,再根据N=nN
A计算氧原子数;
D、标准状况下,四氯化碳是液体,不能使用气体摩尔体积.
解答:解:A、氧气的物质的量为

=1mol,氧元素化合价由-1价升高为0价所以生成32g氧气转移电子数为1mol×2×N
Amol
-1=2N
A,故A错误;
B、100mL0.1mol/L的NaCl溶液中,所含溶质离子总共为0.1L×0.1mol/L×2×N
Amol
-1=0.02N
A,溶液由溶质与溶剂组成,还包含溶剂微粒,故B错误;
C、6gO
2和26gO
3混合气体中的原子的物质的量为
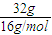
=2mol,所以氧原子的数目为2mol×N
Amol
-1=2N
A,故C正确;
D、标准状况下,四氯化碳是液体,不能使用气体摩尔体积,故D错误.
故选C
点评:本题考查阿伏伽德罗常数的有关计算,难度不大,注意B选项为易错点,容易计算溶质的离子,易忽略溶剂.

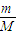 计算氧气的物质的量,氧元素化合价由-1价升高为0价,再根据N=nNA计算转移电子数;
计算氧气的物质的量,氧元素化合价由-1价升高为0价,再根据N=nNA计算转移电子数;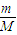 计算氧原子的物质的量,再根据N=nNA计算氧原子数;
计算氧原子的物质的量,再根据N=nNA计算氧原子数; =1mol,氧元素化合价由-1价升高为0价所以生成32g氧气转移电子数为1mol×2×NAmol-1=2NA,故A错误;
=1mol,氧元素化合价由-1价升高为0价所以生成32g氧气转移电子数为1mol×2×NAmol-1=2NA,故A错误;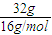 =2mol,所以氧原子的数目为2mol×NAmol-1=2NA,故C正确;
=2mol,所以氧原子的数目为2mol×NAmol-1=2NA,故C正确;
