
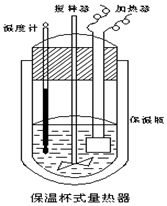
 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )| A. | 该实验测得的中和热△H为-53.3kJ•mol-1 | |
| B. | 若量热计的保温瓶绝热效果不好,则所测得的△H偏大 | |
| C. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| D. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 |
分析 A、先根据溶液反应放出的热量Q=-cm△T+150.5J•0C-1×△T,再根据中和热△H=-$\frac{Q}{n(H{\;}_{2}O)}$计算即可;
B、若量热计的保温瓶绝热效果不好,则会损失一部分热量;
C、CH3COOH溶液与NaOH溶液的反应为中和反应为放热反应;
D、酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差.
解答 解:A.温度差△t=27.7℃-25.0℃=2.7℃,Q=cm△t=2.7×4.184J•g-1•℃-1×200g+150.5J•℃-1×2.7℃=2665.71J=2.67kJ,△H=-$\frac{Q}{n(H{\;}_{2}O)}$=-$\frac{2.67kJ}{0.05mol}$=-53.3 kJ/mol,故A正确;
B.若量热计的保温瓶绝热效果不好,则会损失一部分热量,则测出放出的偏少,△H为负值,故偏大,故B正确;
C.CH3COOH溶液与NaOH溶液的反应为中和反应为放热反应,故C错误;
D.酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和,故D正确;
故选C.
点评 本题考查中和热的测定,题目难度不大,注意理解中和热的概念以及热量计算公式的应用中热量单位的换算.


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
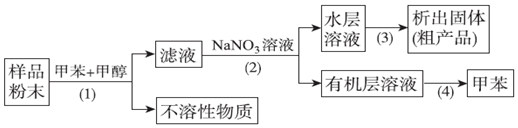
| A. | 步骤(1)需要过滤装置 | |
| B. | 步骤(3)需要用到蒸发皿 | |
| C. | 活性天然产物易溶于有机溶剂难溶于水 | |
| D. | 步骤(4)是利用物质沸点差异进行分离的 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时:电子移动方向由Pb通过导线向PbO2传递 | |
| B. | 充电时:阳极反应是PbSO42-+2e-+2H2O═PbO2+SO42-+4H+ | |
| C. | 放电时:正极反应是Pb-2e-+SO42-═PbSO4 | |
| D. | 充电时:铅蓄电池的阴极应与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是在化学合成中将原子充分利用,转化为新的原子 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 高纯度的晶体桂可以制备晶体管等半导体、电脑芯片 | |
| D. | 酒精、NaCl溶液、CuSO4溶液、浓HNO3都可使蛋白质发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 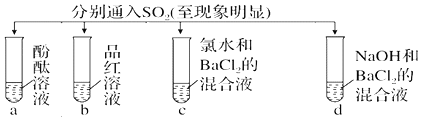 | ||||
| 现象 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 无色 | 无色 | 溶液变无色,白色沉淀 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24L NH3与1.8g H2O,所含的质子数均为NA | |
| B. | 在常温常压下,1mol Cl2与足量的NaOH溶液完全反应,转移电子2NA | |
| C. | 在标准状况下,64g SO2 中含有的原子数为3NA | |
| D. | 在标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molBaCl2中含有的氯离子数为NA | |
| B. | 1mol镁原子中含有的电子数为2NA | |
| C. | 常温常压下,11.2LH2中含有的氢分子数为0.5NA | |
| D. | 16gO3中含有的氧原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com