
”¾ĢāÄæ”æÄ³ŃŠ¾æŠ”×éĶ¬Ń§ĶعżĻĀĮŠĮ÷³ĢÖĘČ”²»ČÜÓŚĖ®ŗĶĻ”ĮņĖįµÄ»Ę¼Ųļ§Ģś·Æ[KNH4Fex(SO4)y(OH)z]£¬²¢ĶعżŹµŃé²ā¶Øѳʷ֊»Ę¼Ųļ§Ģś·ÆµÄÓŠ¹Ų×é³É”£

ŹµŃé²ā¶Ø£ŗ
¢Ł³ĘČ”Ņ»¶ØÖŹĮæµÄѳʷ¼ÓČėĻ”ŃĪĖįÖŠ³ä·ÖČܽā£¬½«ĖłµĆČÜŅŗ×ŖŅĘÖĮČŻĮæĘæ²¢ÅäÖĘ³Él00mLČÜŅŗA£»
¢ŚĮæČ”25.00mLČÜŅŗA£¬¼ÓČėŃĪĖįĖį»ÆµÄBaCl2ČÜŅŗÖĮ³ĮµķĶźČ«£¬¹żĀĖ”¢Ļ“µÓ”¢øÉŌļÖĮŗćÖŲ£¬µĆµ½°×É«¹ĢĢå9.32g£»
¢ŪĮæČ”25.00mLČÜŅŗA£¬¼ÓČė×ćĮæKI£¬ÓĆ2.000mol”¤L©1Na2S2O3ČÜŅŗ½ųŠŠµĪ¶Ø(ŅŃÖŖ·“Ó¦ĪŖI2+2Na2S2O3ØT2NaI+Na2S4O6£¬ĻūŗÄ30.00mL Na2S2O3ČÜŅŗÖĮÖÕµć”£
(1)ŌŚ[KNH4Fex(SO4)y(OH)z]ÖŠx”¢y”¢zµÄ“śŹż¹ŲĻµŹ½ĪŖ ”£
(2)Čō¼ÓČėH2SO4½«pHµ÷½ŚĪŖ2£¬ŌņČÜŅŗc(Fe3+)Ó¦ĪŖ mol”¤L©1”£(ŅŃÖŖKsp[Fe(OH)3]£½4.0”Į10©38)
(3)ŹµŃé²ā¶Ø¢ŚÖŠ¼ģŃé³ĮµķŹĒ·ńĶźČ«µÄ·½·ØŹĒ ”£
(4)øł¾ŻŅŌÉĻŹµŃ鏿¾Ż¼ĘĖćѳʷ֊µÄn(Fe3+)”Ćn(SO42©)”£(Š“³ö¼ĘĖć¹ż³Ģ)
”¾“š°ø”æ(1)3x+2=2y+z (2)0.04 (3)¾²ÖĆ£¬Č”Éś³É³ĮµķŗóµÄÉĻ²ćĒåŅŗ1-2ml£¬µĪ¼ÓÓĆŃĪĖįĖį»ÆµÄĀČ»Æ±µČÜŅŗ£¬ČōĪŽ°×É«³ĮµķÉś³É£¬Ōņ±ķĆ÷³ĮµķŅŃĶźČ« (4)3:2
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ(1)ŌŚ[KNH4Fex(SO4)y(OH)z]ÖŠ£¬KŌŖĖŲ»ÆŗĻ¼Ū+1¼Ū£¬NŌŖĖŲ»ÆŗĻ¼Ū-3¼Ū£¬HŌŖĖŲ»ÆŗĻ¼Ū+1¼Ū£¬SO42-»ÆŗĻ¼Ū“śŹżŗĶĪŖ-2¼Ū£¬OH-»ÆŗĻ¼Ū“śŹżŗĶĪŖ-1¼Ū£¬+1+(-3)+(+1)”Į4++3x+(-2y)+(-1”Įz)=0£¬x”¢y”¢zµÄ“śŹż¹ŲĻµŹ½ĪŖ£ŗ3x+2=2y+z£»
(2)Čō¼ÓČėH2SO4½«pHµ÷½ŚĪŖ2£¬c(OH-)=![]() =10-12mol/L£¬Ksp[Fe(OH)3])=4.0x10-38=c(Fe3+)c3(OH-)£¬c(Fe3+)=
=10-12mol/L£¬Ksp[Fe(OH)3])=4.0x10-38=c(Fe3+)c3(OH-)£¬c(Fe3+)=![]() =0.04mol/L£»
=0.04mol/L£»
(3)ŹµŃé²ā¶Ø¢Ś£¬¼ģŃé³ĮµķŹĒ·ńĶźČ«µÄ·½·ØŹĒ£ŗ¾²ÖĆ£¬Č”Éś³É³ĮµķŗóµÄÉĻ²ćĒåŅŗ1-2ml£¬µĪ¼ÓÓĆŃĪĖįĖį»ÆµÄĀČ»Æ±µČÜŅŗ£¬ČōĪŽ°×É«³ĮµķÉś³É£¬Ōņ±ķĆ÷³ĮµķŅŃĶźČ«£»
(4)¢Ł³ĘČ”Ņ»¶ØÖŹĮæµÄѳʷ¼ÓČėĻ”ŃĪĖįÖŠ³ä·ÖČܽā£¬½«ĖłµĆČÜŅŗ×ŖŅĘÖĮČŻĘ÷Ęæ²¢ÅäÖĘ³Él00.00mL ČÜŅŗA£»¢ŚĮæČ”25.00mLČÜŅŗA£¬¼ÓČėŃĪĖįĖį»ÆµÄBaCl2ČÜŅŗÖĮ³ĮµķĶźČ«£¬¹żĀĖ”¢Ļ“µÓ”¢øÉŌļÖĮŗćÖŲ£¬µĆµ½°×É«¹ĢĢå9.32g£»¢ŪĮæČ”25.00mLČÜŅŗA£¬¼ÓČė×ćĮæKI£¬ÓĆ2.000molL-1Na2S2O3ČÜŅŗ½ųŠŠµĪ¶Ø(ŅŃÖŖ·“Ó¦ĪŖI2+2Na2S2O3ØT2NaI+Na2S4O6£¬ĻūŗÄ30.00mL Na2S2O3ČÜŅŗÖĮÖÕµć£»25mlČÜŅŗÖŠĮņĖįøłĄė×ÓĪļÖŹµÄĮæŗĶĮņĖį±µĪļÖŹµÄĮæĻąĶ¬£¬n(SO42-)=n(BaSO4)=![]() =0.04mol£¬
=0.04mol£¬
2Fe3+”«I2”«2Na2S2O3
2 1 2
n(Fe3+)=2n(I2)=n(Na2S2O3)=2.000mol/L”Į0.03L=0.06mol£¬
ѳʷ֊µÄn(Fe3+)£ŗn(SO42-)=0.06mol£ŗ0.04mol=3£ŗ2”£


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ³żĮć×åŌŖĖŲĶā£¬¶ĢÖÜĘŚŌŖĖŲµÄ×īøß»ÆŗĻ¼ŪŌŚŹżÖµÉĻ¶¼µČÓŚøĆŌŖĖŲĖłŹōµÄ×åŠņŹż
B. µēĄėÄÜ×īŠ”µÄµē×ÓÄÜĮæ×īøß
C. Ķ¬ŹĒsÄܼ¶£¬ŌŚ²»Ķ¬µÄµē×Ó²ćÖŠĖłÄÜČŻÄɵÄ×ī¶ąµē×ÓŹżŹĒ²»ĻąĶ¬µÄ
D. ŗĖĶāµē×ÓÅŲ¼ĶźČ«ĻąĶ¬µÄĮ½ÖÖĪ¢Į££¬Ęä»ÆѧŠŌÖŹŅ»¶ØĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ¢ŁCH3OH£Øg£©+3/2O2£Øg£©=CO2£Øg£©+2H2O£Øg£©”÷H=£akJ”¤molŅ»1
¢ŚCH4£Øg£©+2O2£Øg£©=CO2£Øg£©+2H2O£Øg£©”÷H=£bkJ”¤molŅ»1
¢ŪCH4£Øg£©+2O2£Øg£©=CO2£Øg£©+2H2O£Ø1£©”÷H=£ckJ”¤molŅ»1
ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A£®ÓÉÉĻŹöČČ»Æѧ·½³ĢŹ½æÉÖŖb>c
B£®¼×ĶéµÄČ¼ÉÕČČĪŖbkJ/mol
C£®2CH3OH£Øg£©=2CH4£Øg£© +O2£Øg£© ”÷H=2£ØbŅ»a£©KJ molŅ»1
D£®µ±¼×“¼ŗĶ¼×ĶéĪļÖŹµÄĮæÖ®±ČĪŖ1:2Ź±£¬ĘäĶźČ«Č¼ÉÕÉś³ÉCO2ŗĶH2O£Ø1£©Ź±£¬·Å³öµÄČČĮæĪŖQ kJ£¬ŌņøĆ»ģŗĻĪļÖŠ¼×“¼µÄĪļÖŹµÄĮæĪŖQ/£Øa+2b£© mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆŗĻĪļGŹĒÉśĆüŗĻ³ÉŗĖĖįµÄ±ŲŠčĒ°ĢåĪļÖŹ£¬¶Ō»śĢåĆāŅß¹¦ÄÜŗĶŠŽø“¾ßÓŠÖŲŅŖ×÷ÓĆ”£»ÆŗĻĪļG µÄŅ»ÖÖŗĻ³ÉĀ·ĻßČēĻĀ£ŗ
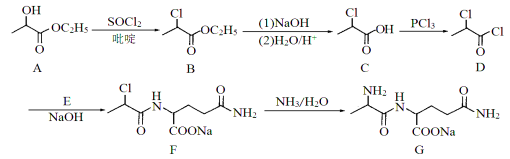
(1)»ÆŗĻĪļAÖŠŗ¬Ńõ¹ŁÄÜĶŵÄĆū³ĘĪŖ ŗĶ ”£
(2)»ÆŗĻĪļEµÄ·Ö×ÓŹ½ĪŖC5H10O3N2£¬Ęä½į¹¹¼ņŹ½ĪŖ £»ÓÉF”śGµÄ·“Ó¦ĄąŠĶĪŖ ”£
(3)Ņ»¶ØĢõ¼žĻĀFæÉ×Ŗ»ÆĪŖH(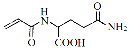 )£¬Š“³öĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄHµÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ ”£
)£¬Š“³öĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄHµÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ ”£
¢ŁÄÜÓėFeCl3ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦£» ¢ŚÄÜÓėŃĪĖį·“Ó¦£» ¢Ū·Ö×ÓÖŠÖ»ŗ¬ÓŠ3ÖÖ²»Ķ¬»Æѧ»·¾³µÄĒā”£
(4)ŅŃÖŖ£ŗ¢Ł![]() ¢Ś
¢Ś![]() ”£ĒėŠ“³öŅŌ
”£ĒėŠ“³öŅŌ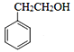 ĪŖŌĮĻÖʱø
ĪŖŌĮĻÖʱø![]() µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼(ĪŽ»śŹŌ¼ĮČĪÓĆ£¬ŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼Ź¾Ąż¼ū±¾ĢāĢāøÉ)”£
µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼(ĪŽ»śŹŌ¼ĮČĪÓĆ£¬ŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼Ź¾Ąż¼ū±¾ĢāĢāøÉ)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬Ģå»ż¾łĪŖ1 LµÄĖÄøöĆܱÕČŻĘ÷ÖŠ£¬±£³ÖĪĀ¶ČŗĶČŻ»ż²»±ä£¬ŅŌĖÄÖÖ²»Ķ¬µÄĶ¶ĮĻ·½Ź½½ųŠŠ·“Ó¦”£Ę½ŗāŹ±ÓŠ¹ŲŹż¾ŻČēĻĀ£ØŅŃÖŖ2SO2£Øg£©£«O2£Øg£© ![]() 2SO3£Øg£©¦¤H£½£196.6 kJ”¤mol£1£©”£
2SO3£Øg£©¦¤H£½£196.6 kJ”¤mol£1£©”£
ČŻĘ÷ | ¼× | ŅŅ | ±ū | ¶” |
ĘšŹ¼Ķ¶ĮĻĮæ | 2molSO2 1mol O2 | 1 mol SO2 0.5mol O2 | 2mol SO3 | 2mol SO2 2mol O2 |
·“Ó¦·Å³ö»ņĪüŹÕµÄČČĮæ£ØkJ£© | a | b | c | d |
Ę½ŗāŹ±c£ØSO3£© £Ømol”¤L£1£© | e | f | g | h |
ĻĀĮŠ¹ŲĻµÕżČ·µÄŹĒ£Ø £©
A£®a£½c£»e£½g B£®a>2b£»e>2f C£®a>d£»e>h D£®c£«98.3e>196.6
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”放ĪļÖŹ½į¹¹ÓėŠŌÖŹ”æīѱ»³ĘĪŖ”°¹ś·Ą½šŹō”±ŗĶ”°ÉśĪļ½šŹō”±£¬ŹĒÖŲŅŖµÄ½į¹¹²ÄĮĻ”£
(1)»łĢ¬īŃŌ×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ŹĒ ”£
(2)½šŗģŹÆ(TiO2)µÄČŪµć1825”ę£¬ÓĆČŪŃĪ·ØÖ±½Óµē½ā½šŗģŹÆæÉ»ńµĆ½šŹōīŃ£¬½šŗģŹÆĖłŹōµÄ¾§ĢåĄąŠĶŹĒ ¾§Ģ唣
(3)TiCl4ÄÜÓėNH4Cl·“Ӧɜ³ÉÅäŗĻĪļ(NH4)2[TiCl6]”£
¢Ł“ĖÅäŗĻĪļÖŠ£¬ŠĪ³ÉÅäĪ»¼üŹ±Ģį¹©¹Ā¶Ōµē×ÓµÄÓŠ ”£(ĢīŌŖĖŲ·ūŗÅ)
¢ŚÓėNH4£«»„ĪŖµČµē×ÓĢåµÄŅ»ÖÖŅõĄė×ÓĪŖ ”£(Ģī»ÆѧŹ½)
(4)TiO2+ÓėH2O2ŌŚĻ”ĖįÖŠ·“Ӧɜ³ÉéŁŗģÉ«µÄ[TiO(H2O2)]2+Ąė×Ó£¬æÉÓĆÓŚīŃµÄ¶ØŠŌ¼ģŃ锣ĻĀĮŠ¹ŲÓŚH2O2µÄĖµ·ØÕżČ·µÄŹĒ ”£(ĢīŠņŗÅ)
A£®æռ乹ŠĶĪŖÖ±ĻߊĪ |
B£®ŗ¬·Ē¼«ŠŌ¼üµÄ¼«ŠŌ·Ö×Ó |
C£®OŌ×Ó¹ģµĄŌÓ»ÆĄąŠĶĪŖsp3 |
D£®»ÆѧŠŌÖŹ²»ĪČ¶ØŹĒŅņĪŖĒā¼üµÄ¼üÄܽĻŠ” |
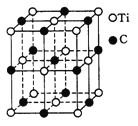
(5)×ī½ü·¢ĻÖŅ»ÖÖÓÉīŃ(Ti)Ō×ÓŗĶĢ¼Ō×Ó¹¹³ÉµÄĘųĢ¬ĶÅ“Ų·Ö×Ó£¬½į¹¹Ä£ŠĶČēĶ¼ĖłŹ¾£¬ĖüµÄ·Ö×ÓŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦A2(g)+2B2(g) ![]() 2AB2(g)”÷H£¼0£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
2AB2(g)”÷H£¼0£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
A£®ÉżøßĪĀ¶Č£¬ÕżĻņ·“Ó¦ĖŁĀŹŌö¼Ó£¬ÄęĻņ·“Ó¦ĖŁĀŹ¼õŠ”
B£®ÉżøßĪĀ¶ČÓŠĄūÓŚ·“Ó¦ĖŁĀŹŌö¼Ó£¬“Ó¶ųĖõ¶Ģ“ļµ½Ę½ŗāµÄŹ±¼ä
C£®“ļµ½Ę½ŗāŗó£¬ÉżøßĪĀ¶Č»ņŌö“óŃ¹Ē涼ӊĄūÓŚøĆ·“Ó¦Ę½ŗāÕżĻņŅʶÆ
D£®“ļµ½Ę½ŗāŗ󣬽µµĶĪĀ¶Č»ņ¼õŠ”Ń¹Ē涼ӊĄūÓŚøĆ·“Ó¦Ę½ŗāÕżĻņŅʶÆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[»Æѧ------Ń”ŠŽ3£ŗĪļÖŹ½į¹¹ÓėŠŌÖŹ]
M”¢R”¢X”¢YĪŖŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ£¬ZŹĒŅ»ÖÖ¹ż¶ÉŌŖĖŲ”£M»łĢ¬Ō×ÓL²ćÖŠp¹ģµĄµē×ÓŹżŹĒs¹ģµĄµē×ÓŹżµÄ2±¶£¬RŹĒĶ¬ÖÜĘŚŌŖĖŲÖŠ×ī»īĘĆµÄ½šŹōŌŖĖŲ£¬XŗĶMŠĪ³ÉµÄŅ»ÖÖ»ÆŗĻĪļŹĒŅżĘšĖįÓźµÄÖ÷ŅŖ“óĘųĪŪČ¾Īļ£¬ZµÄ»łĢ¬Ō×Ó4sŗĶ3d¹ģµĄ°ė³äĀś”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©R»łĢ¬Ō×ӵĵē×ÓÅŲ¼Ź½ŹĒ £¬XŗĶYÖŠµēøŗŠŌ½Ļ“óµÄŹĒ (ĢīŌŖĖŲ·ūŗÅ)”£
£Ø2£©XµÄĒā»ÆĪļµÄ·ŠµćµĶÓŚÓėĘä×é³ÉĻąĖʵÄMµÄĒā»ÆĪļ£¬ĘäŌŅņŹĒ___________”£
£Ø3£©XÓėMŠĪ³ÉµÄXM3·Ö×ÓµÄæռ乹ŠĶŹĒ__________”£
£Ø4£©MŗĶRĖłŠĪ³ÉµÄŅ»ÖÖĄė×Ó»ÆŗĻĪļR2M¾§ĢåµÄ¾§°ūČēĶ¼ĖłŹ¾£¬
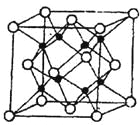
ŌņĶ¼ÖŠŗŚĒņ“ś±ķµÄĄė×ÓŹĒ_________(ĢīĄė×Ó·ūŗÅ)£¬øĆĄė×ÓµÄÅäĪ»ŹżĪŖ ”£øĆ¾§°ū²ĪŹża="b=c=d" pm £¬ĮŠŹ½¼ĘĖćR2M¾§ĢåµÄĆܶČĪŖ g/cm”£
£Ø5£©ŌŚĻ”ĮņĖįÖŠ£¬ZµÄ×īøß¼Ūŗ¬ŃõĖįµÄ¼ŲŃĪ(³ČÉ«)Ńõ»ÆMµÄŅ»ÖÖĒā»ÆĪļ£¬Z±»»¹ŌĪŖ+3¼Ū£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ__________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com