
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式____________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式___________ _____________。
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式______________________________________________。
②分析产品室可得到H3PO2的原因________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有________杂质,该杂质产生的原因是________________________。
解析:(1)因为H3PO2是一元中强酸,只有部分发生电离,电离方程式为H3PO2H++H2PO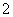 。
。
(2)①H3PO2中P元素化合价为+1。②根据H3PO2与Ag+反应中两者物质的量之比为1∶4,4 mol Ag+在反应中得到4 mol e-,1 mol H3PO2则失去4 mol e-,所以P元素将显+5价,产物为H3PO4,即氧化产物为H3PO4。③根据H3PO2是一元中强酸,可以判断NaH2PO2是正盐,属于弱酸强碱盐,因H2PO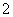 水解而使溶液呈弱碱性。
水解而使溶液呈弱碱性。
(3)依据氧化还原反应方程式配平原则,得6H2O+2P4+3Ba(OH)2===2PH3↑+3Ba(H2PO2)2。(4)①阳极发生氧化反应,在反应中OH-失去电子,电极反应式为2H2O-4e-===4H++O2↑。②H2O放电产生H+,H+进入产品室,原料室中的H2PO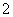 穿过阴膜扩散至产品室,二者发生反应:H++H2PO
穿过阴膜扩散至产品室,二者发生反应:H++H2PO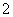 H3PO2。③如果撤去阳膜,H2PO
H3PO2。③如果撤去阳膜,H2PO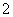 或H3PO2可能被氧化。
或H3PO2可能被氧化。
答案:(1) H3PO2H++H2PO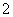
(2)①+1 ②H3PO4 ③正盐 弱碱性
(3)6H2O+2P4 +3Ba(OH)2===2PH3↑+3Ba(H2PO2)2
(4)①2H2O-4e-===O2↑+4H+ ②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO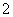 穿过阴膜扩散至产品室,二者反应生成H3PO2 ③PO
穿过阴膜扩散至产品室,二者反应生成H3PO2 ③PO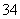 H2PO
H2PO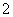 或H3PO2被氧化
或H3PO2被氧化
点拨:知识:氧化还原反应及电离方程式、电极反应方程式的书写等。能力:考查学生对一元中强酸、正盐、弱酸强碱盐的理解和应用能力及电极反应式的书写等。试题难度:中等。


科目:高中化学 来源: 题型:
2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”。查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性。下列对其说法中正确的是
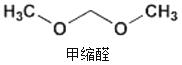 A.甲缩醛和乙醛互为同系物
A.甲缩醛和乙醛互为同系物
B.用甲醇和甲醛生产甲缩醛的反应为加成反应
C.等物质的量的甲缩醛和丙炔完全燃烧的耗氧量相同
D.用甲缩醛生产杀虫剂、皮革和汽车上光剂等,均是利用了它的毒性
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是制备和研究乙炔性质的实验装置图。下列说法不正确的是( )
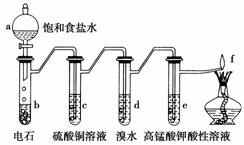
A.制备乙炔的反应原理是CaC2+2H2O―→Ca(OH)2+C2H2↑
B.c的作用是除去影响后续实验的杂质
C.d中的有机产物与AgNO3溶液混合能产生沉淀
D.e中的现象说明乙炔能被高锰酸钾酸性溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质。已知:A+B―→D+F,A+C―→E+F;0.1 mol·L-1 D溶液的pH为13(25 ℃)。下列说法正确的是( )
A.原子半径:丁>丙>乙>甲
B.1 mol A与足量B完全反应共转移了2 mol电子
C.丙元素在周期表中的位置为第二周期ⅣA族
D.A中既有离子键又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
1-氯丙烷与强碱的醇溶液共热后,生成的产物再与溴水反应,得到一种有机物A,A的同分异构体(包括A)共有( )
A.3种 B.4种
C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理常采用:2NaClO3+4HCl═2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法中正确的是( )
|
| A. | 浓盐酸在反应中仅体现还原性 |
|
| B. | 每生成0.1mol ClO2转移0.5mol电子 |
|
| C. | 氧化性:NaClO3<ClO2 |
|
| D. | 被氧化和被还原的物质的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
|
| A. | 乙酸乙酯和水,酒精和水,植物油和水 |
|
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 |
|
| C. | 甘油和水,乙酸和水,乙酸和乙醇 |
|
| D. | 汽油和水,苯和水,乙酸和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在比较酸的强弱时,必须考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力.比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc.下列关于酸性强弱的说法正确的是( )
|
| A. | 在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙 |
|
| B. | 比较HCl、H2SO4、HClO4、HNO3酸性的强弱,用水肯定不可以,用冰醋酸可能可以 |
|
| C. | HNO3在HClO4中是酸,在H2SO4中可能是碱 |
|
| D. | 比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
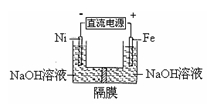
A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com