
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
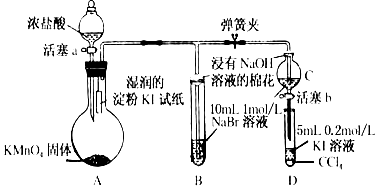
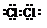
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食物溶于水后的溶液pH<7,则称为酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋自质是酸性食物 | |
| C. | 蔬菜、水果是酸性食物 | |
| D. | 柠檬酸是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)
由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液pH=7 | |
| B. | 25℃时,0.2 mol•L-1 Ba(OH)2溶液和0.2 mol•L-1 HCl等体积混合,所得溶液pH=7 | |
| C. | 25℃时,0.2 mol•L-1 NaOH溶液和0.2 mol•L-1 CH3COOH恰好中和,所得溶液pH=7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
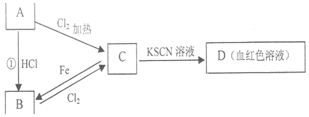 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
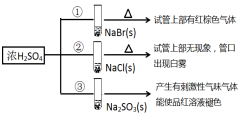
| A. | 对比①和②可以说明还原性Br->Cl- | |
| B. | ①和③相比可说明氧化性Br2>SO2 | |
| C. | ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl | |
| D. | ③中浓H2SO4被还原成SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
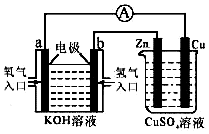
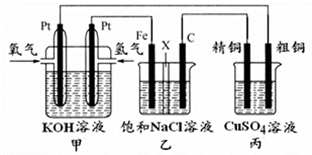 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com