
| A. | 1L0.1mol•L-1的酒精溶液中含氢原子数为0.6NA | |
| B. | 常温常压下,1L1L0.1mol•L-1的醋酸铵溶液中含氮原子数目为0.1NA | |
| C. | 1mol有机物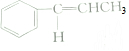 中含有5NA和碳碳双键 中含有5NA和碳碳双键 | |
| D. | 1mol甲基(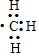 )所含的电子数为7NA )所含的电子数为7NA |
分析 A.水中还含有氢原子;
B.氮原子的物质的量等于醋酸铵的物质的量;
C.苯环中不含碳碳双键;
D.电子式表示原子最外层电子,不是原子所有电子.
解答 解:A.1L 0.1mol•L-1的酒精溶液中乙醇的物质的量为0.1mol,乙醇的分子式为C2H6O,则0.1mol乙醇中的氢原子数为0.6NA,水中还含有氢原子,则溶液中的氢原子大于0.6NA,故A错误;
B.1L 0.1mol•L-1的醋酸铵溶液中n(CH3COONH4)=0.1mol,氮原子的物质的量等于醋酸铵的物质的量,则氮原子数目为0.1NA,故B正确;
C.苯环中不含碳碳双键,是介于单键与双键之间独特的键,则1mol有机物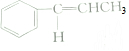 中含有NA个碳碳双键,故C错误;
中含有NA个碳碳双键,故C错误;
D.C有6个电子,H有1个电子,则1个甲基(-CH3)有9个电子,所以1mol甲基(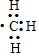 )所含的电子数为9NA,故D错误;
)所含的电子数为9NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的判断及计算,熟练掌握公式的使用和物质的结构是解题关键,选项D为易错点,注意电子式中的小黑点不是原子所有电子,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、Al(OH)3 | B. | AgNO3、NH4Cl | C. | MgSO4、BaCl2 | D. | CuCl2、Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯和水 | B. | 硝酸钾和氯化钠 | C. | 乙酸乙酯和乙酸 | D. | 食盐水和泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
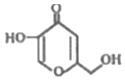
| A. | 分子中所有碳原子不可能共平面 | |
| B. | 能发生酯化反应、氧化反应、还原反应 | |
| C. | lmol该物质与H2完全加成,需消耗3mol H2 | |
| D. | 比该物质少一个O原子,属于芳香族化合物的同分异构体有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
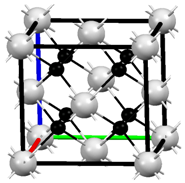 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 34g H2O2和H2S混合物中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | B. | 按规定对生活废弃物进行分类放置 | ||
| C. | 经常使用一次性筷子、塑料袋 | D. | 深入农村和社区,加强环保宣传 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com