
25℃时,水的电离达到平衡:H2O H++OH-。下列叙述错误的是( )
H++OH-。下列叙述错误的是( )
A.向水中通入氨气,平衡逆向移动,c(OH-)增大
B.向水中加入少量稀硫 酸,c(H+)增大,KW不变
酸,c(H+)增大,KW不变
C.将水加热平衡正向移动,KW变大
D.升高温度,平衡正向移动,c(H+)增大,pH不变
科目:高中化学 来源: 题型:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H 0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1;反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a:T 100℃(填“大于”或“小于”),判断理由是 。
b:列式计算温度T时反应的平衡常数K2 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有28gCuO和MgO固体混合物与200ml硫酸恰好完全反应,将反应后的溶液小心蒸干,得到固体68g。则原硫酸溶液的物质的量浓度和原固体混合物中氧元素的质量分数分别是( )
A.2.5mol•L-1 28.57% B. 2.2mol•L-1 23.07%
C. 1.5mol•L-1 24.55% D.2.5mol•L-1 18.37%
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
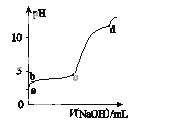
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-Al( OH)3
OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5× 10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应
10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应 (Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO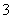 )、c(NO
)、c(NO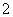 )和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
)和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液一定呈酸性的是( )
A.c(H+)=10-6mol·L-1的溶
B.pH<7的溶液
C.c(H+)>c(OH-)的溶液
D.使紫色石蕊试液呈红色的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.使用滴定管时,滴定管必须用待装液润洗2~3次
B.滴定操作中,若用待测液润洗锥形瓶,将导致测定结果偏高
C.用10 mL的量筒量取8.58 mL 0.10 mol·L-1的稀盐酸
D.稀释浓硫酸时,将浓硫酸缓缓加入水中,并不 断用玻璃棒搅拌
断用玻璃棒搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O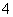 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com