
分析 纯碱样品中常混有NaCl,用沉淀法测定该样品中Na2CO3的质量分数,可以将样品溶于水得溶液,在溶液中加入氯化钙得碳酸钙沉淀,生成的沉淀需要经过过滤、洗涤、干燥,根据生成沉淀的质量可计算出样品中碳酸钠的质量分数,据此答题.
解答 解:纯碱样品中常混有NaCl,用沉淀法测定该样品中Na2CO3的质量分数,可以将样品溶于水得溶液,在溶液中加入氯化钙溶液得碳酸钙沉淀,生成的沉淀需要经过过滤、洗涤、干燥,根据生成沉淀的质量结合样品的质量可计算出样品中碳酸钠的质量分数,
(1)根据上面的分析可知,需要向样品溶液中加入足量的CaCl2作为沉淀剂,故答案为:CaCl2;
(2)含有碳酸钠的样品溶液中加入氯化钙溶液得碳酸钙沉淀,反应的离子方程式为Ca2++CO32-=CaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;
(3)根据上面的分析可知,需要测量的物理量有样品的质量和生成沉淀的质量,故答案为:样品的质量和生成沉淀的质量;
(4)生成的沉淀表面有氯离子杂质,所以检验上述反应生成的沉淀是否洗净的方法是取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,则沉淀洗净,
故答案为:取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,则沉淀洗净.
点评 本题以测定样品中Na2CO3的质量分数为背景,考查了物质的分离、化学实验基本操作、实验结果的处理等知识,难度中等.


科目:高中化学 来源: 题型:解答题
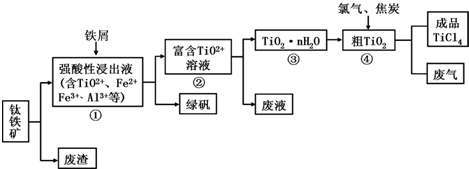
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
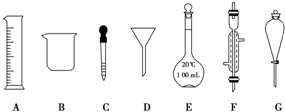 实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.
实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO${\;}_{3}^{-}$、Cl- | |
| B. | 0.1 mol•L-1FeCl3溶液:K+、NH${\;}_{4}^{+}$、I-、OH- | |
| C. | pH=1的溶液:S2-、NH4+、Cl-、Na+ | |
| D. | 能使酚酞变红的溶液中:K+、Na+、SO${\;}_{4}^{2-}$、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

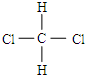 和
和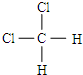 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和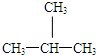
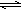 HCO3-+OH-
HCO3-+OH-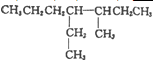 的系统命名为:3-甲基-4-乙基-庚烷
的系统命名为:3-甲基-4-乙基-庚烷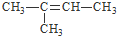 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的PH | 3.2 | 8.8 | 5.0 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水呈浅黄绿色,久置的氯水无色 | |
| B. | 新制的氯水漂白作用强,而久置的氯水漂白作用很弱 | |
| C. | 新制的氯水所含成分多,而久置的氯水所含成分少 | |
| D. | 新制的氯水中无氯离子,而久置的氯水中则含氯离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com