
【题目】已知2.3克某有机物在氧气中完全燃烧,只生成4.4克二氧化碳和2.7克水。
(1)计算确定该有机物的最简式________。
(2)若该有机物的相对分子质量为46,写出其分子式__________。
【答案】C2H6O C2H6O
【解析】
根据燃烧产生CO2、H2O可确定其中含有C、H两种元素,根据CO2中的C、H2O中的H的质量和与2.3g有机物质量大小判断有机物中是否含有O元素,根据元素的物质的量的比确定实验式,再结合相对分子质量是最简式的整数比来确定有机物分子式。
(1)有机物燃烧产生CO2、H2O,可直接判断有机物含有碳、氢元素,4.4克CO2中含碳元素质量m(C)=![]() ×4.4g=1.2g,n(C)=1.2g÷12g/mol=0.1mol;2.7克H2O中含氢元素质量为m(H)=
×4.4g=1.2g,n(C)=1.2g÷12g/mol=0.1mol;2.7克H2O中含氢元素质量为m(H)=![]() ×2.7g=0.3g,n(H)=0.3g÷1g/mol=0.3mol,1.2g+0.3g=1.5g<2.3g,可判断该有机物还含有氧元素,其质量为m(O)=2.3g-1.5g=0.8g,n(O)=0.8g÷16g/mol=0.05mol,n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2∶6∶1,根据N=nNA可知:微粒的物质的量的比等于原子个数比,所以有机物分子中C、H、O原子个数比为2∶6∶1,因此该有机物的最简式为C2H6O;
×2.7g=0.3g,n(H)=0.3g÷1g/mol=0.3mol,1.2g+0.3g=1.5g<2.3g,可判断该有机物还含有氧元素,其质量为m(O)=2.3g-1.5g=0.8g,n(O)=0.8g÷16g/mol=0.05mol,n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2∶6∶1,根据N=nNA可知:微粒的物质的量的比等于原子个数比,所以有机物分子中C、H、O原子个数比为2∶6∶1,因此该有机物的最简式为C2H6O;
(2)该有机物最简式是C2H6O,式量是46,等于该有机物的相对分子质量,说明最简式就是分子式,所以有机物的分子式为C2H6O。


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】下列反应能发生并用于化工生产的是()
A.制盐酸:Cl2+H2![]() 2HCl
2HCl
B.制取镁:MgCl2(溶液)![]() Mg+Cl2
Mg+Cl2
C.制乙烯:C2H5OH![]() CH2=CH2+H2O
CH2=CH2+H2O
D.制乙醇:CH2=CH2+H2O![]() C2H5OH
C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对新冠肺炎病毒可以采用的消毒剂常见的有“84”消毒液,医用酒精它们的有效成分分别是NaClO、![]() ,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
(1)以上涉及元素包含______个主族、______个周期;按原子半径由小到大排列依次为____________(用元素符号表示);有2个未成对电子元素是______;非金属性:O>Cl,请列举一个事实________________________。
(2)![]() 是______(“电解质”,“非电解质”);75%酒精的“75%”是______(“质量分数分数”,“体积分数”),
是______(“电解质”,“非电解质”);75%酒精的“75%”是______(“质量分数分数”,“体积分数”),![]() 分子中的氢原子的类型有______种(“2”,“3”或“4”)。
分子中的氢原子的类型有______种(“2”,“3”或“4”)。
(3)NaClO的电子式______,其溶液中的离子浓度由大到小顺序__________________。某化学工作者在家自制“84”消毒液如图
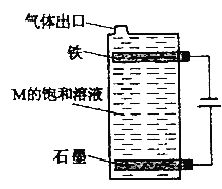
(4)①M的化学式______,铁是______极;②请阐述该装置能够制取消毒液的理由:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为______。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是______。
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入______。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______(填“变大”“变小”或“不变”)。
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) ==== CH3OH(g) 。该反应的ΔH为_____ kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积相同的两个容器中,充入等质量CO2和CO气体,下列判断正确的是( )
A.CO2和CO对容器产生的压强之比是7∶11
B.CO2和CO的密度之比是11∶7
C.CO2和CO的分子数相等
D.CO2和CO的氧原子个数比是22∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是熔点高的金属,可与氯气反应制氯化钴![]() ,氯化钴易潮解,可用于催化剂的制备、氨的吸收等。制备氯化钴的装置如图所示。
,氯化钴易潮解,可用于催化剂的制备、氨的吸收等。制备氯化钴的装置如图所示。
已知:![]() 的氧化性强于
的氧化性强于![]() 。
。

(1)检查![]() 装置气密性的方法:用止水夹夹住
装置气密性的方法:用止水夹夹住![]() 、
、![]() 之间的橡皮管,向分液漏斗中加水,________(将步骤补充完整),证明装置
之间的橡皮管,向分液漏斗中加水,________(将步骤补充完整),证明装置![]() 气密性良好。
气密性良好。
(2)装置![]() 烧瓶中的固体为漂粉精,烧瓶中发生反应的化学方程式________。
烧瓶中的固体为漂粉精,烧瓶中发生反应的化学方程式________。
(3)装置![]() 的洗气瓶中盛放的试剂是________,装置
的洗气瓶中盛放的试剂是________,装置![]() 硬质玻璃管中的玻璃纤维的作用是________。
硬质玻璃管中的玻璃纤维的作用是________。
(4)![]() 中物质的名称________,其作用是________。
中物质的名称________,其作用是________。
(5)钴有多种氧化物,![]() 与浓盐酸反应的离子方程式是________。
与浓盐酸反应的离子方程式是________。
(6)氯化钴溶液与氯化铝溶液类似,直接蒸干不能得到![]() 固体,使氯化亚砜
固体,使氯化亚砜![]() 与
与![]() 混合加热可以得到氯化钴固体,原因是________。
混合加热可以得到氯化钴固体,原因是________。
(7)向氯化钴溶液中加入草酸钠![]() ,生成草酸钴晶体
,生成草酸钴晶体![]() ,将草酸钴晶体在空气中充分加热,将反应生成的气态物质通人澄清石灰水中生成沉淀的质量为的
,将草酸钴晶体在空气中充分加热,将反应生成的气态物质通人澄清石灰水中生成沉淀的质量为的![]() ,剩余固体为钴的某种氧化物,其质量为
,剩余固体为钴的某种氧化物,其质量为![]() ,计算确定钴的氧化物的化学式是________。
,计算确定钴的氧化物的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
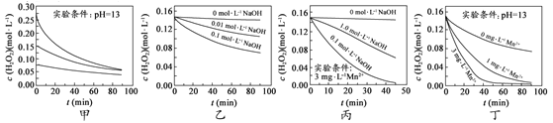
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的 ΔH________0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B, 反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,再次达平衡时A的转化率 ________(填“增大”、“减小”或“不变”);
(3)下列选项可作为判断该反应达到平衡的依据是______:
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com