
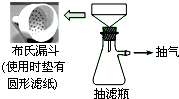
 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.分析 (1)利用抽气泵使抽滤瓶中的压强降低,快速达到固液分离的目的,修剪滤纸,使其略小于布式漏斗,但要把所有的孔都覆盖住,并滴加蒸馏水使滤纸与漏斗连接紧密;
(2)移取20.00mL待测液需要精密量具,精确到0.01ml,滴定实验中有滴定管和移液管;维生素C在酸性溶液中能被碘氧化,依据碘单质遇到淀粉变蓝色可以选取淀粉指示反应的终点;
(3)维生素C具有还原性,易被空气中的氧气氧化分析;
(4)利用维生素C标准溶液消耗碘单质量计算50g卷心菜中所含维生素C的质量,换算为1kg卷心菜中所含维生素C的质量,每片维生素C质量为20mg,计算得到卷心菜中维生素C相当于多少维生素C片.
解答 解:(1)分析可知与过滤相比,抽滤的优点是加快过滤速率,快速达到固液分离的目的,修剪滤纸,使其略小于布式漏斗,但要把所有的孔都覆盖住;
故答案为:加快过滤速率,小于;
(2)移取20.00mL待测液选用的仪器是精密量具,精确到0.01ml,维生素C又称L-抗坏血酸,为酸性己糖衍生物可以选择移液管或酸式滴定管移取,移取维生素C标准溶液于锥形瓶中,加入1mL 0.1mol•L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010mol•L-1碘水滴定到终点,碘单质遇到淀粉变蓝,所以费用终点是滴入最后一滴碘水,溶液无色变化为蓝色且半分钟不变证明反应终点;
故答案为:20 mL移液管或酸式滴定管,蓝;
(3)维生素遇空气和加热都易引起变质,在碱性溶液中易于氧化而失效,在空气条件下,被空气中的氧气氧化在水溶液中迅速变质,是强还原剂;
故答案为:维生素C被空气中的氧气氧化;
(4)利用标准溶液中维生素C含量的测定和卷心菜汁中维生素C含量的测定,金属50g卷心菜中维生素C的质量,
设为xmg,则100:0.01mol/L×V1×$\frac{250}{20}$=x:0.01mol/L×V2×$\frac{50}{20}$
x=$\frac{{20{V_2}}}{V_1}$mg
1000g卷心菜中含有维生素C质量=$\frac{{20{V_2}}}{V_1}$mg×$\frac{1000g}{50g}$=$\frac{400{V}_{2}}{{V}_{1}}$mg
每片维生素C质量为20mg,则1000g卷心菜中含有维生素C的片数=$\frac{400{V}_{2}}{20×{V}_{1}}$=$\frac{{20{V_2}}}{V_1}$;
故答案为:$\frac{{20{V_2}}}{V_1}$;
点评 本题考查了化学实验标定和测定溶液含量的过程分析判断和计算应用,注意各溶液体积变化和操作过程的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜接电源的正极 | |
| B. | 电解一段时间后,溶液中Cu2+减小 | |
| C. | 若电路中通过1 mol电子,有0.5 mol铜被氧化 | |
| D. | 阴极反应只有Cu2++2e-→Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
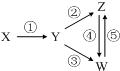 下列各组物质中,能一步实现如图所示①~⑤转化关系的是( )
下列各组物质中,能一步实现如图所示①~⑤转化关系的是( )| X | Y | Z | W | |
| A | Fe3O4 | Fe | FeCl2 | FeCl3 |
| B | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| C | H2SO4 | SO2 | S | SO3 |
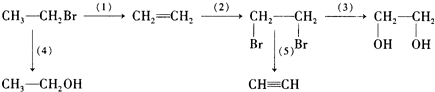
| D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | 分子中氢原子的化学环境只有一种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使高锰酸钾酸性溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | X | Y | Z | W |  |
| A | NaOH | Na2CO3 | NaHCO3 | NaCl | |
| B | Cl2 | Ca(ClO)2 | HClO | HCl | |
| C | Si | SiO2 | Na2SiO3 | H2SiO3 | |
| D | FeCl3 | FeCl2 | Fe(OH)2 | Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com