
| A、X、W、R的最高价氧化物的水化物酸性强弱顺序是X<W<R |
| B、气态氢化物的稳定性:Y>R |
| C、X、Y、W、R的原子半径由大到小的顺序为R>W>X>Y |
| D、X、W的氧化物由固态转化为气态时,克服相同的作用力 |
| 2+8 |
| 2 |
| 2+8 |
| 2 |


科目:高中化学 来源: 题型:
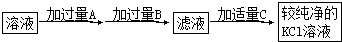
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用物质A表示反应的平均速率为0.3 mol?L-1?s-1 |
| B、用物质B表示反应的平均速率为0.3 mol?L-1?s-1 |
| C、2 s时物质A的转化率为70% |
| D、2 s时物质B的浓度为0.3 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L的甲酸溶液中c(H+)约为1×10-2 mol/L |
| B、甲酸能与水以任意比例互溶 |
| C、1mol/L的甲酸溶液10mL恰好与10mL1mol/L的NaOH溶液完全反应 |
| D、甲酸溶液的导电性比盐酸弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH减小 |
| B、CH3COOH的电离程度增大 |
| C、溶液的导电能力减小 |
| D、溶液的c(OH-) 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0△S>0 |
| B、△H<0△S<0 |
| C、△H<0△S>0 |
| D、△H>0△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaOH溶液中慢慢滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 |
| B、胶体与其他分散系的本质区别是胶体能发生丁达尔效应 |
| C、除去Fe(OH)3胶体中的Na+和Cl-可用过滤的方法 |
| D、Fe(OH)3胶体中逐滴加入稀硫酸,会产生沉淀而后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
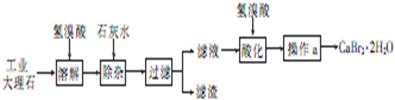
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com