
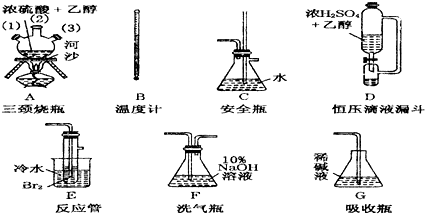
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、PH<7 |
| B、PH=7 |
| C、PH>7 |
| D、上述三种均有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
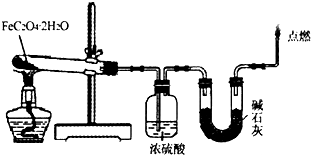 (1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
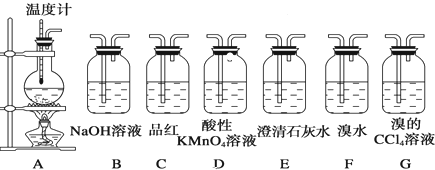
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液中离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B、发生反应生成的AgI沉淀多于AgCl沉淀 |
| C、在水中AgCl的溶解度比AgI的溶解度大 |
| D、若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com