
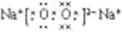 ;形成过程左边相同原子可以合并写,右边是二氧化碳的电子式,所以形成过程为
;形成过程左边相同原子可以合并写,右边是二氧化碳的电子式,所以形成过程为 ,故答案为:
,故答案为: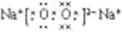 ;
; ;
;
| ||
| 高温高压 |
| ||
| 高温高压 |


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
| A、将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4+ |
| B、1mol/LCH3COOH与1mol/L CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA |
| C、常温常压下,3.6g H2O中含有电子数为2NA |
| D、含有2NA个氧原子的氧气与臭氧的混合气体的质量为32g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
| B、向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| C、向20 mL0.15 mol/L氢碘酸中通入224 mL Cl2(标准状况):2HI+Cl2═2H++I2+2Cl- |
| D、向40 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):2OH-+CO2═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
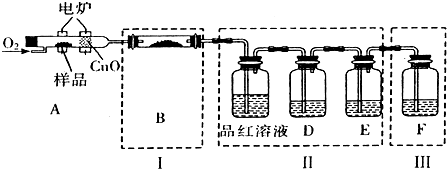
查看答案和解析>>
科目:高中化学 来源: 题型:


| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
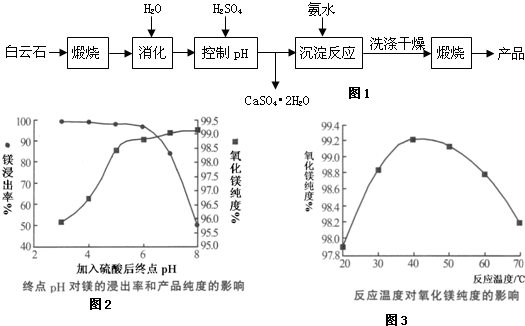
查看答案和解析>>
科目:高中化学 来源: 题型:
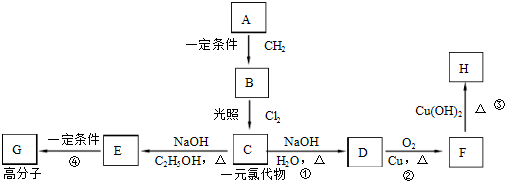
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| B | 向浓度均为0.1mol?L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向溶液X中滴加稀盐酸 | 有气体产生 | 溶液X 中一定含有CO32- |
| D | 向含H2SO4的淀粉水解液中加入新制的Cu(OH)2,煮沸 | 没有砖红色沉淀 | 淀粉未水解 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com