
| A、升高 | B、降低 |
| C、不变 | D、无法确定 |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| 微热 |
| A、浓硫酸比硝酸稳定 |
| B、浓硫酸的沸点比硝酸高 |
| C、H2SO4的酸性比硝酸强 |
| D、浓硫酸的氧化性比硝酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | Ⅰ | Ⅱ |
| A | 向Ca(OH)2 溶液中加入足量NaHCO3溶液 | 向NaHCO3溶液中加入足量Ca(OH)2溶液 |
| B | 向NH3?H2O溶液加入过量AlCl3溶液 | 向AlCl3溶液加入过量NH3?H2O溶液 |
| C | 将少量HCl溶液滴入Na2CO3溶液中 | 将少量Na2CO3溶液滴入过量HCl溶液中 |
| D | 将少量氯气通入过量FeBr2溶液中 | 将过量氯气通入少量FeBr2溶液中 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有X、Y、Z三种物质,它们之间存在如图转化关系:
有X、Y、Z三种物质,它们之间存在如图转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同条件下,导电性强的溶液比导电性弱的溶液中自由移动离子数目多 |
| B、由C(石墨)→C(金刚石)△H=+11.9kJ?mol-1可知,金刚石比石墨稳定 |
| C、在AgNO3溶液中加入过量的稀盐酸后,溶液中不存在Ag+ |
| D、任何一个化学变化都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023 |
| B、2.9g 熟石膏(2 CaSO4?H2O)含有的结晶水分子数为0.02NA |
| C、常温下,将5.6g铁投入足量的稀硫酸中,充分反应,转移电子数为0.3 NA |
| D、31g 白磷(P4)所含磷原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2 |
| B、H2SO4 |
| C、Na2SO4 |
| D、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用稀盐酸和氢氧化钡溶液进行酸碱中和反应实验,该反应过程中溶液酸碱度变化及相关数据如图所示.
用稀盐酸和氢氧化钡溶液进行酸碱中和反应实验,该反应过程中溶液酸碱度变化及相关数据如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
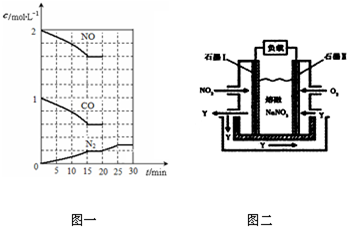
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com