
| A、①②④⑤⑧ | B、②③⑤⑦⑧ |
| C、②③④⑦⑧ | D、全部 |
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
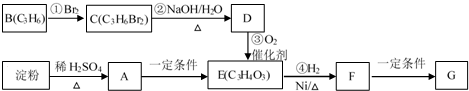
| H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 磷酸毗醛基素是细胞重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯,其结构式如图,下列说法错误的是( )
磷酸毗醛基素是细胞重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯,其结构式如图,下列说法错误的是( )| A、能与金属钠反应 |
| B、能使石蕊试液变红 |
| C、能发生银镜反应 |
| D、1 mol 该酯与NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | Na+ | K+ | Ca 2+ | Mg 2+ | Cl- | SO4 2- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、H2R是二元弱酸,其Ka1=1×10-2 |
| B、当溶液恰好呈中性时,c( Na +)=2c ( R2-)+c( HR-) |
| C、NaHR在溶液中水解倾向大于电离倾向 |
| D、含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=6的纯水:c(OH-)<c(H+) |
| B、0.1mol?L-1的(NH4)2SO4溶液:c(NH4+)>c(SO42-)>c(H+) |
| C、常温下,pH=7的醋酸与醋酸钠的混合溶液:c(CH3COO-)>c(Na+) |
| D、常温下,pH=2的一元酸和pH=12的一元强碱等体积混合后所得溶液:c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com