
| A�� | ǰ2 min��D��ƽ����Ӧ����Ϊ0.2 mol•L-1•min-1 | |
| B�� | ��ʱ��B��ƽ��ת������40% | |
| C�� | �������ϵ��ѹǿ��ƽ�ⲻ�ƶ�����ѧƽ�ⳣ������ | |
| D�� | ����B��ƽ�������ƶ���B��ƽ��ת�������� |
���� 2L���ܱ������У�����4molA��2molB�������·�Ӧ��3A��g��+2B��g��?4C��s��+2D��g������Ӧһ��ʱ���ﵽƽ�⣬�������1.6mol C����
3A��g��+2B��g��?4C��s��+D��g��
��ʼ 4 2 0 0
ת�� 1.2 0.8 1.6 0.4
ƽ�� 2.8 1.2 1.6 0.4
A������v=$\frac{��c}{��t}$���㣻
B�����ݷ���ʽ����μӷ�Ӧ��B�����ʵ������ٸ���ת���ʶ�����㣻
C��CΪ���壬����ѹǿ��ƽ�������ƶ���
D������ijһ��Ӧ���Ũ�ȣ�ƽ��������Ӧ�ƶ���������Ӧ���ת������������ת���ʽ��ͣ�
��� �⣺2L���ܱ������У�����4molA��2molB�������·�Ӧ��3A��g��+2B��g��?4C��s��+2D��g������Ӧһ��ʱ���ﵽƽ�⣬�������1.6mol C����
3A��g��+2B��g��?4C��s��+D��g��
��ʼ 4 2 0 0
ת�� 1.2 0.8 1.6 0.4
ƽ�� 2.8 1.2 1.6 0.4
A��v=$\frac{��c}{��t}$=$\frac{\frac{0.4mol}{2L}}{2min}$=0.1 mol•L-1•min-1����A����
B���ﵽƽ�⣬�μӷ�Ӧ��B�����ʵ���Ϊ1.6mol��$\frac{1}{2}$=0.8mol����B��ת����Ϊ$\frac{0.8mol}{2mol}$��100%=40%����B��ȷ��
C���÷�Ӧ����ӦΪ���������С�ķ�Ӧ������ѹǿƽ��������Ӧ�ƶ����������ƶ�����ѧƽ�ⳣ��ֻ���¶�Ӱ�죬����ѹǿƽ�ⳣ�����䣬��C����
D������B��Ũ������ƽ��������Ӧ�ƶ���A��ת��������B��ת���ʽ��ͣ���D����
��ѡB��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬����ƽ�ⳣ�������塢Ũ�Ⱥ�ѹǿ��ƽ���Ӱ�졢ת���ʼ���Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�ⷴӦ��CΪ���壬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NA��H+������Ϊ1 g | |
| B�� | 2 L 0.5 mol/L Na2SO4��Һ�к�NA��Na+ | |
| C�� | 32 g O2�к���2NA����ԭ�� | |
| D�� | ��״���£�1 mol H2O�к���NA������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
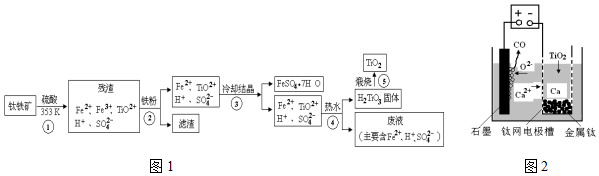
 ��һ��������þ�����Ļ����Ͷ��100mL�����У�����ȫ���ܽ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ�������ǽ��������ᷴӦʱHCl�Ļӷ�����
��һ��������þ�����Ļ����Ͷ��100mL�����У�����ȫ���ܽ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ�������ǽ��������ᷴӦʱHCl�Ļӷ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
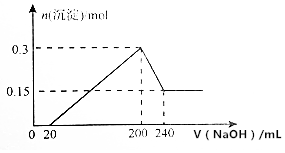
 ����ͼ��ʾ��װ�ý��е��ʵ�飮A����ͭ���Ͻ�B��Ϊ��ͭ���������ҺΪ����ͭ��Һ����������ͨ��һ��ʱ���A��ǡ��ȫ���ܽ⣬��ʱB����������3.2g����Һ��������0.05g������֪�����ԣ�Cu2+��Ni2+����A�Ͻ���ͭ����ԭ�Ӹ�����Ϊ��������
����ͼ��ʾ��װ�ý��е��ʵ�飮A����ͭ���Ͻ�B��Ϊ��ͭ���������ҺΪ����ͭ��Һ����������ͨ��һ��ʱ���A��ǡ��ȫ���ܽ⣬��ʱB����������3.2g����Һ��������0.05g������֪�����ԣ�Cu2+��Ni2+����A�Ͻ���ͭ����ԭ�Ӹ�����Ϊ��������| A�� | 4��1 | B�� | 3��1 | C�� | 2��1 | D�� | 1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 Ԫ��R��X��T��Z��Q��Ԫ�����ڱ��е����λ�������ʾ������R�����ڰ�����H2���һ��ϲ�������ը���������ж���ȷ���ǣ�������
Ԫ��R��X��T��Z��Q��Ԫ�����ڱ��е����λ�������ʾ������R�����ڰ�����H2���һ��ϲ�������ը���������ж���ȷ���ǣ�������| A�� | �ǽ����ԣ�X��T��Z | B�� | ��һ�����ܣ�X��T��Z | ||
| C�� | ��̬�⻯��Ļ�ԭ�ԣ�X��T��R | D�� | ����������ˮ�������ԣ�Q��T��R |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
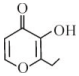
| A�� | ���л���ķ���ʽΪC7H7O3 | |
| B�� | 1 mol���л���ֻ����2 mol H2�����ӳɷ�Ӧ | |
| C�� | ���л�����һ���������ܷ���ȡ����������Ӧ | |
| D�� | ���л����һ�ַ�����ͬ���칹���ܷ���������Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com