
科目:高中化学 来源: 题型:
下表中物质的分类组合完全正确的是( )
| 编号 | A | B | C | D |
| 强电解质 | Ba(OH)2 | 盐酸 | HClO4 | BaSO4 |
| 弱电解质 | HI | CaCO3 | HClO | NH3·H2O |
| 非电解质 | SO2 | NH3 | Cl2 | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
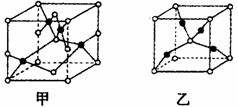
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,△H1 > △H2 的是( )
①C(s)+O2(g)===CO2(g) △H1 C(s)+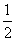 O2(g)===CO(g) △H2
O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+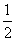 O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
对于CH4、C3H4、C2H4、C2H6、C3H6五种烃,回答下列有关问题:
(1)等质量的上述五种烃,在相同状况下体积最大的是______________ 。
(2)等质量的上述五种烃,完全燃烧生成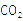 最多的是________________。
最多的是________________。
(3)在120 ℃、1.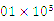 Pa条件下,与足量的
Pa条件下,与足量的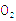 混合点燃,完全燃烧前后气体体积没有变化的烃是___________________________。
混合点燃,完全燃烧前后气体体积没有变化的烃是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.用CH3COOH溶解CaCO3: CaCO3+2H+=Ca2++H2O+C02↑
B.Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH- Fe(OH)3↓+ BaSO4↓
C.硫酸工业尾气中的SO2用过量的氨水吸收:2NH3·H2O+ SO2 =2NH4++ SO32-+H2O
D.Cu溶于浓HNO3:Cu+ 4H++ 2NO3一=Cu2++ 2NO↑+ 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能在指定溶液中大量共存的是( )
①无色溶液中:Al3+,Cl-,Na+,HCO3-,SO42-
②使pH=11的溶液中:Na+,AlO2-,NO3-,S2-,SO32-
③加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
④使pH试纸呈红色的溶液中:Fe3+,MnO4-,Na+,SO42-
⑤酸性溶液中:Fe2+,Al3+,NO3-,I-
A.①②④ B.①⑤ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定的环境中能大量存在的是
A.pH=1的无色溶液中:SO42—、Cu2+、Na+、Cl—
B.能使石蕊试纸变蓝色的溶液中:Na+、K+、S2—、CO32—
C.加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3—
D.水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
38.取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和 。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
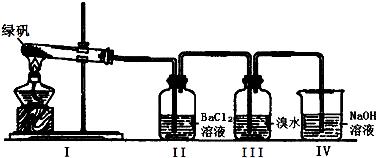
39. II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是 。
A.Fe2O3、SO3、H2O B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
40. III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是 。
41. NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式: 。
(三)探究FeSO4中Fe2+还原性:
42. 证明FeSO4有较强的还原性,完成下表。
| 实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
|
| 步骤二: |
|
(四)硫酸亚铁用途探究
43. 缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com