
相同温度下,体积均为0.25 L的两个恒容容器中发生可逆反应:
X2(g)+3Y2(g) 2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热46.3 kJ |
② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应平衡时XY3的平衡浓度相同
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届甘肃省张掖市高三上第一次诊断考试理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.在FeSO4溶液中加入H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O
B.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH-═CaCO3↓+H2O
C.向FeBr2溶液中通入少量的氯气:2Br-+Cl2 = 2Cl-+Br2
D.向NaClO溶液中通入少量SO2:SO2 + ClO-+ H2O = SO42- + Cl- +2H+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上12月月考化学试卷(解析版) 题型:选择题
下列制取单质的反应中,化合物作还原剂的是
A.2C+SiO2 Si+2CO↑ B.Zn+H2SO4(稀)=ZnSO4+H2↑
Si+2CO↑ B.Zn+H2SO4(稀)=ZnSO4+H2↑
C.Br2+2NaI=I2+2NaBr D.2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上12月月考化学试卷(解析版) 题型:选择题
室温下,水的电离达到平衡:H2O H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
A.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大.
B.将水加热,平衡向正反应方向移动,Kw不变
C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第三次段考化学试卷(解析版) 题型:选择题
下列溶液中有关微粒的物质的量浓度关系正确的是
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl—)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<②
D.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:实验题
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
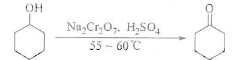
环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g-cm-3,200C) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
水 | 100.0 | 0.9982 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用红外光谱图,可确定环己酮分子含官能团名称
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:选择题
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)
电解池:2Al+3H2O  Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷(解析版) 题型:选择题
在密闭容器中发生下列反应aA(g) 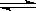 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
“纳米技术”广泛应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳
米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是
A.能全部通过半透膜 B.能发生丁达尔现象
C.一定能导电 D.一定为悬浊液或乳浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com