


科目:高中化学 来源: 题型:
| A、胶体的分散质能透过滤纸 |
| B、胶体能产生丁达尔现象 |
| C、胶体是纯净物,其它分散系是混合物 |
| D、胶体的分散质粒子直径在1~100 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 电解质溶液 | HCl | AgNO3 | KOH | BaCl2 |
| pH变化 | 减小 | 增大 | 增大 | 不变 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
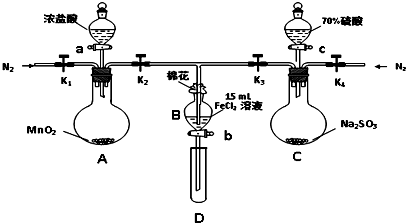
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
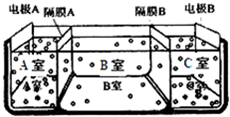 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
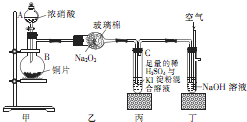 某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题| 装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
| 乙 | 淡黄色固体变白色 | Na2O2+2NO2═2NaNO3 | |
| 丙 | 氧化性 |
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测溶液于试管A中,加入几滴 |
|
| 步骤② | |
|
| 步骤③ | 另取少量待测溶液于试管C中,加入足量氯水,再加入四氯化碳,静置后观察颜色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com