
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C 表示10s内反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是_______________。
(3)10s末,生成物D的浓度为______________________。
(4)A 平衡转化率______________。
【答案】0.04mol/(L·s) 1.5mol/L 0.4mol/L 40%
【解析】
根据三段式解题: 3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
起始浓度(mol/L) 1.5 0.5 0 0
变化浓度(mol/L) 0.6 0.2 0.4 0.4
平衡浓度(mol/L) 0.9 0.3 0.4 0.4
(1)10s末,C的物质的量为0.8mol,所以用C表示的正反应的化学反应速率为v(C)=![]() =
=![]() =0.04mol/(L·s),故答案为:0.04mol/(L·s)。
=0.04mol/(L·s),故答案为:0.04mol/(L·s)。
(2)10s末,达到平衡,测得A的物质的量为1.8mol,C的物质的量为0.8mol,由反应的化学计量数之比可知,反应前A的物质的量浓度为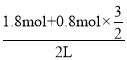 =1.5mol/L,故答案为:1.5mol/L。
=1.5mol/L,故答案为:1.5mol/L。
(3)由C、D的化学计量数之比可知平衡后生成的D的物质的量也为0.8mol,所以其浓度为![]() =0.4mol/L,故答案为:0.4mol/L。
=0.4mol/L,故答案为:0.4mol/L。
(4)A的平衡转化率为![]() ×100%=40%,故答案为:40%。
×100%=40%,故答案为:40%。


科目:高中化学 来源: 题型:
【题目】(1)现向含AgCl的饱和溶液中:
①加入AgNO3固体,则c(Ag+)______,c(Cl-)______;(填“变大”、“变小”或“不变”,下同)
②加入NaI固体,则c(Ag+)______,c(Cl-)______。
(2)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:Ca5(PO4)3(s)![]() 5Ca2+(aq)+3PO43-(aq)+OH-(aq)。进食后细菌和酶作用于食物,产生有机酸,使牙齿受到腐蚀,叙述其原因_____________。已知Ca5(PO4)3F(固)的溶解度比Ca5(PO4)3OH更小,质地更坚固。若牙膏中添加含F-的氟化物后,能有效防止龋齿,请用离子方程式解释原因_________________________________。
5Ca2+(aq)+3PO43-(aq)+OH-(aq)。进食后细菌和酶作用于食物,产生有机酸,使牙齿受到腐蚀,叙述其原因_____________。已知Ca5(PO4)3F(固)的溶解度比Ca5(PO4)3OH更小,质地更坚固。若牙膏中添加含F-的氟化物后,能有效防止龋齿,请用离子方程式解释原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
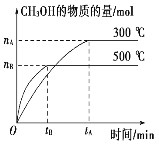
(1)该反应的平衡常数表达式K=_______;
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表 示的化学反应速率是______(用 nB,tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
B. 已知, N2 (g) + 3 H2(g)![]() 2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
D. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对恒温恒容密闭容器中的可逆反应:A(g)+3B(g)![]() 2C(g) H <0,下列错误的是( )
2C(g) H <0,下列错误的是( )
A. 升高温度,v(正)、v(逆)都增大,但v(逆)增加的程度更大
B. 增大压强,v(正)、v(逆)都增大,但v(正)增加的程度更大
C. 增大A的浓度,v(正)会增大,但v(逆)会减小
D. 使用催化剂,一般v(正)、v(逆)同时增大,而且增大的倍数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一化学反应aA+bB=C,根据影响化学反应速率的因素可得v(C)=kcm(A)cn(B)。其中k是与温度有关的常数,为测k、m、n的值,在298 K时,将A、B溶液按不同的浓度混合,得到下列实验数据:
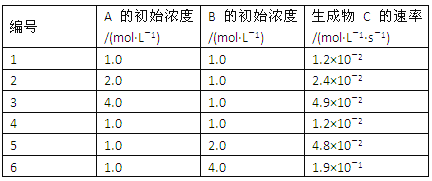
(1)根据上表可求得:m=_______,n=______,k=________。
(2) 当c(A)=c(B)=2.0mol/L时,用B表示的初始反应速率为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是

A. 图甲表示有无催化剂的反应,加催化剂可以改变反应的焓变
B. 图乙表示等浓度等体积的NaCl、NaBr及NaI溶液分别用AgNO3溶液滴定曲线,a为Cl-
C. 图丙表示等浓度等体积的盐酸和醋酸分别用NaOH溶液的滴定曲线,指示剂都可用酚酞
D. 图丁表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是

A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。
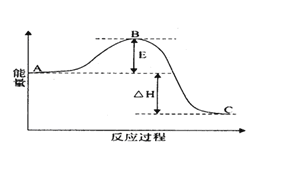
已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJmol-1.请回答下列问题:
(1)E的大小对该反应的反应热______(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高”还是“降低”)。
(2)完成SO2氧化为SO3的热化学方程式______________________。
(II)用 50mL0.50mol/L 盐酸与 50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
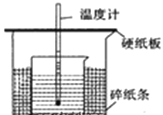
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。实验中能否用环形铜丝搅拌棒代替该用品_______(填“能”或“否”)
(2)向盐酸溶液中加入NaOH溶液的正确操作是_______(从下列选出)。
A.沿玻璃棒缓慢倒入 B. —次迅速倒入 C.分三次少量倒入
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会_____(填“偏大”、“偏小”、“无影响”)。
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是__________________。
A.测量完盐酸的温度再次测最NaOH溶液温度时,温度计上残留的酸液未用水冲洗干净。
B.做本实验的当天室温较高 C.大小烧杯口不平齐,小烧杯口未接触硬纸板。
D.在量取盐酸时仰视读数 E.大烧杯的盖板中间小孔太大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com