
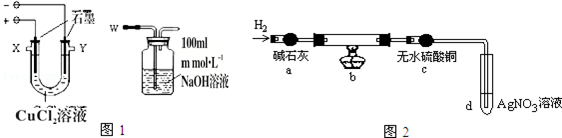
| �������Ƽ���ѧʽ | �Ȼ���ͭCuCl | ��ʽ�Ȼ�ͭCu2��OH��3Cl |
| ���� | ��ɫ���塢����ˮ | ��ɫ���塢����ˮ |
���� ��1��������������ʧ������������������������������Һ���գ�
��2�����ݿ��ܺͼ����ɫ���ʿ���Ϊͭ��������ͭ��
��3����ˮ����ͭ����ɫ˵������̼���ϵIJ�����������Ӧ������û��ˮ��
��4��װ��b�з�����Ӧ�Ļ�ѧ����ʽΪ�Ȼ�������������Ӧ����ͭ���Ȼ��⣻
��5���缫�Ȼ�ͭ��Һ����ͭ���ӵõ���������ͭ���Ӻ��Ȼ���ͭ���ݴ�д�ɵ缫��Ӧ�����ӷ���ʽ�����ݷ�Ӧ2CuCl+H2=2Cu+2HCl����Ӧǰ����������仯Ϊ��Ԫ�������������㣻
��6��NaClO��H2O2��Ӧ����������NaCl��ˮ����ֹ����ζ�ʱ��NaClO��Ӧ��
��7��������Ԫ���غ����Ԫ���غ㣺n��NaOH��=2n��NaClO��+n��NaCl����n��NaCl���ǵζ�����������NaOH��Ӧ���ɵģ���ϵζ�ʱ���ĵ�������㣮
��� �⣺��1��������������ʧ������������������������������Һ���գ�����������X����������W��
�ʴ�Ϊ��X��
��2�������ݼ�������������������ɫ���ʿ���ΪCu��Cu2O������߶��У�
�ʴ�Ϊ��Cu��
��3��������ˮ����ͭ����ɫ��֤��b�з�Ӧ����û��ˮ���ɣ�̼���ϵĺ�ɫ������û����Ԫ�أ�һ�����Ậ��������ͭ��һ������ͭ������ˮ����ͭ�������ɫ����������Cu2O��
�ʴ�Ϊ�������ɫ����������Cu2O��
��4��װ��b�з�����ӦΪCuCl��������Ӧ����Ӧ�Ļ�ѧ����ʽΪ��2CuCl+H2=2Cu+2HCl��
�ʴ�Ϊ��2CuCl+H2=2Cu+2HCl��
��5�����CuCl2��Һʱ�������Ϸ����ķ�ӦΪͭ���ӵõ���������ͭ��Cu2++2e-=Cu��ͭ����ʧȥ���������Ȼ���ͭ��Cu2++e-+Cl-=CuCl����2CuCl+H2=2Cu+2HCl����Ӧǰ����������仯Ϊ��Ԫ����������ɫ����ΪCuCl������n��CuCl��=n��Cl��=$\frac{W{\;}_{1}-W{\;}_{2}}{35.5}$mol��
�ʴ�Ϊ��Cu2++e-+Cl-=CuCl����$\frac{W{\;}_{1}-W{\;}_{2}}{35.5}$mol��
��6��NaClO��H2O2��Ӧ����������NaCl��ˮ����ֹ����ζ�ʱ��NaClO��Ӧ���䷴Ӧ�ķ���ʽΪ��NaClO+H2O2=O2��+NaCl+H2O��
�ʴ�Ϊ��NaClO+H2O2=O2��+NaCl+H2O��
��7��������Ԫ���غ����Ԫ���غ㣺n��NaOH��=2n��NaClO��+n��NaCl����n��NaCl���ǵζ�����������NaOH��Ӧ���ɵģ�
��0.1m��$\frac{20mL}{100mL}$=2n��NaClO��+nV��10-3����n��NaClO��=$\frac{1}{2}$��0.02m-nV��10-3��mol��
����c��NaClO��=$\frac{\frac{1}{2}����0.02m-nV��10{\;}^{-3}��}{0.02}$=$\frac{20m-nV}{40}$mol/L��
�ʴ�Ϊ��$\frac{20m-nV}{40}$��
���� ���⿼�����ʵļ����������Ŀ�Ѷ��еȣ������ۺ���ǿ������������ѧ������˼ά�����ͷ�ɢ˼ά���������ѧ����Ӧ��������ѧϰЧ�ʣ�����������Ҫע����ǽ������ʵļ���ʱ��Ҫ�������ʵ��������ʺ�������Ӧ��ѡ���ʵ����Լ��ͷ�����


 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
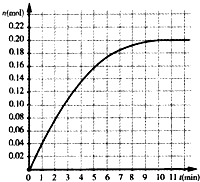 ���������£����ݻ�Ϊ2L���ܱ������ڼ���0.4mol��N2��1.6mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g������Ӧ��NH3���ʵ����仯�����ͼ������˵�����������ǣ�������
���������£����ݻ�Ϊ2L���ܱ������ڼ���0.4mol��N2��1.6mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g������Ӧ��NH3���ʵ����仯�����ͼ������˵�����������ǣ�������| A�� | �����������䣬������5L�����ﵽƽ����Ҫ��ʱ�佫����10min | |
| B�� | N2ƽ��ת����Ϊ25% | |
| C�� | ƽ��ʱ������ѹǿΪ��ʼʱ��90% | |
| D�� | ��Ӧǰ10min��Ӧ����v��H2��=0.01mol?L-1?min-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | FeCl3��Һ | B�� | CuSO4��Һ | C�� | ��� | D�� | ��ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������ | ����� | ǿ����� | ������� | �ǵ���� | |
| A | ���� | Ư�� | �մ� | ˮ | ���� |
| B | �������� | ������������ | ���ᱵ | ��ˮ | �Ҵ� |
| C | ���� | ˮú�� | ���� | ���� | �ɱ� |
| D | ʯ��ʯ | ˮ���� | �Ȼ��� | �������� | ̼��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

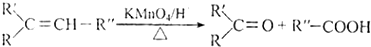
 ��
�� ��
��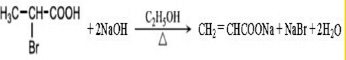 ��
��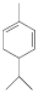 ��A������ʵ�����Br2���мӳɷ�Ӧ�IJ��ﹲ��3�֣������������칹����
��A������ʵ�����Br2���мӳɷ�Ӧ�IJ��ﹲ��3�֣������������칹�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com