
| A. | SO2是很好的抑菌剂,红酒中常加人微量的SO2 | |
| B. | 麦片中常加人微量铁粉,可以防止被氧化而变质 | |
| C. | “PM2.5“是指大气中直径≤2.5微米的颗粒物.其悬浮在空气中一定形成气溶胶 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
分析 A.二氧化硫有漂白性,水溶液呈酸性;
B.铁有还原性,可防止食品被氧化而变质;
C.胶体粒子的直径介于1nm~100nm(10-9m~10-7m)之间,PM2.5是指大气中直径≤2.5×10-6m的颗粒物,可能形成胶体,但不一定形成气溶胶;
D.不锈钢属于合金.
解答 解:A.二氧化硫有漂白性,SO2是很好的抑菌剂,红酒中常加人微量的SO2,故A正确;
B.麦片中常加人微量铁粉,铁有还原性,可以防止被氧化而变质,故B正确;
C.胶体粒子的直径介于1nm~100nm(10-9m~10-7m)之间,PM2.5是指大气中直径≤2.5×10-6m的颗粒物,可能形成胶体,但不一定形成气溶胶,故C错误;
D.制饭勺、饭盒、高压锅等的不锈钢是合金,故D正确.
故选C.
点评 本题考查较为综合,涉及环境污染、氧化还原、合金以及胶体等问题,为高考常见题型,掌握基础是解题关键,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:多选题
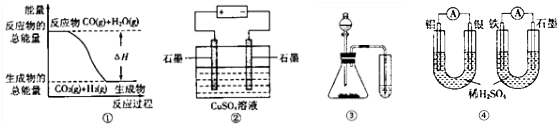
| A. | 图①表示可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0 | |
| B. | 图②为电解硫酸铜溶液的装置,一段时间后,阴、阳两极有可能收集到相同体积的气体 | |
| C. | 图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的试验 | |
| D. | 图④两个装置中个,通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ•mol-1) | 414.4 | 615.3 | 347.4 | 435.5 |
| A. | +288.8kJ/mo1 | B. | -703.4 kJ/mo1 | C. | +125.4kJ/mo1 | D. | -125.4 kJ/mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应剧烈 | |
| B. | 锶在纯净氮气中可以燃烧,燃烧产物投入水中可以放出气体 | |
| C. | 锶在纯氧中点燃可燃烧,燃烧生产的产物投入水中可以放出气体 | |
| D. | 颗粒状的单质锶投入水中,剧烈反应,生成大量的气体并引起气体燃烧和轻微爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
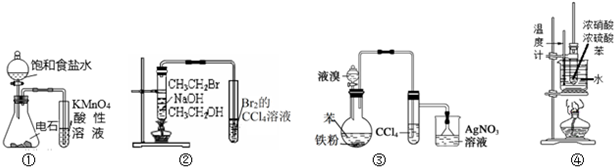
| A. | 装置①可用于检验乙炔的还原性 | |
| B. | 装置②可以证明CH3CH2Br发生消去反应生成了乙烯 | |
| C. | 装置③可以证明苯生成溴苯的反应是取代反应 | |
| D. | 装置④可用于实验室制备硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
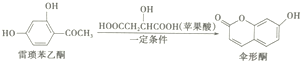
| A. | 雷梭苯乙酮有两种含氧官能团 | |
| B. | 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH | |
| C. | 伞形酮难溶于水 | |
| D. | 雷梭苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
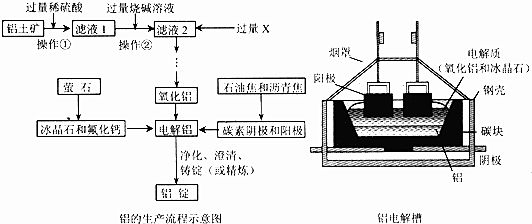
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨技术实现了“从空气到面包” | |
| B. | 合成氨涉及氧化还原反应 | |
| C. | 高效催化剂是合成氨反应的重要条件 | |
| D. | 合成氨所需要的氢气主要来自于电解水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com